
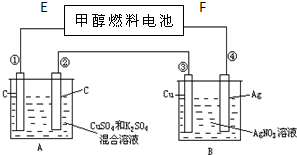
 如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题:
如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题:| 1.6g×6mol |
| 32g |


科目:高中化学 来源: 题型:
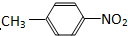 和
和 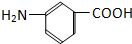
查看答案和解析>>
科目:高中化学 来源: 题型:
| 共价键 | 键能(KJ/mol) |
| N≡N | 946 |
| H-H | 436 |
| H-N | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200 mL 0.1 mol/L NH4Cl 溶液 |
| B、50 mL 0.2 mol/L NH4NO3溶液 |
| C、100 mL 0.2 mol/L NH4HSO4 |
| D、50 mL 0.2 mol/L氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ℃ | NO2 | HF |
| 熔点 | -11.2 | -83.6 |
| 沸点 | 21.0 | 19.52 |
| A、20.0 gHF中含σ键数目为1.0NA |
| B、将22.4LNH3溶于1L水中,溶液含有OH-数目为0.1NA |
| C、6.72 LNO2与水反应后,转移的电子数为0.2NA |
| D、H2S和SO2各0.l mol反应后,体系中的S原子数目小于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:C>D>A>B |
| B、A的氧化物一定为酸性氧化物 |
| C、元素B和C只能形成一种化合物 |
| D、A、C、D的最高价氧化物对应的水化物均能两两相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、320g | B、160g |
| C、64g | D、32g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气是非电解质,氨水是电解质 |
| B、氢氧化铁胶体可以发生丁达尔现象 |
| C、摩尔和物质的量均是联系宏观和微观数量的物理量 |
| D、二氧化硅既可和酸又可和碱反应,所以二氧化硅是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com