
| A. | 按系统命名法,化合物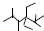 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 用甘氨酸[H2N-CH2-COOH]和丙氨酸[CH3CH(NH2)COOH]缩合最多可形成3 种二肽 | |
| D. | 乙醇、乙二醇、丙三醇的沸点依次升高 |
分析 A.烷烃的命名原则:长、多、近、小、简,据此书写结构简式即可;
B.碳碳双键和醛基能使酸性KMnO4 溶液褪色;
C.氨基酸形成肽键原理为羧基提供-OH,氨基提供-H,两个氨基酸分子脱去一个水分子脱水结合形成二肽,既要考虑不同氨基酸分子间生成二肽,又要考虑同种氨基酸分子间形成二肽;
D.-OH越多,沸点越高.
解答 解:A.取代基的位次和最小,化合物 的名称是2,2,4,5-四甲基-3,3-二乙基己烷,故A错误;
的名称是2,2,4,5-四甲基-3,3-二乙基己烷,故A错误;
B.碳碳双键和醛基能使酸性KMnO4 溶液褪色,无法鉴别,故B错误;
C.氨基酸生成二肽,就是两个氨基酸分子脱去一个水分子.当同种氨基酸脱水,生成2种二肽;当是异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽,所以共有4种,故C错误;
D.-OH越多,沸点越高,则乙醇、乙二醇、丙三醇的沸点依次升高,故D正确.
故选D.
点评 本题考查有机物的命名、结构与性质,为高频考点,把握官能团与性质的关系、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液的浓度变为0.08mol/L | B. | 阳极上产生112ml O2 (标准状况) | ||
| C. | 转移的电子数是1.204×1022 个 | D. | 反应中有0.01mol Ag 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
| B | H2O2 | 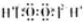 | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| B. | 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等,还可用于杀菌消毒 | |
| C. | 废旧钢材焊接前,分别用饱和Na2CO3,NH4Cl溶液处理焊点 | |
| D. | 聚丙烯酸钠树脂广泛应用于植物移栽及制作尿不湿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H216O和20gH218O含有的质子数均为10 NA | |
| B. | l Ll mol/L的KAl(SO4)2溶液中阳离子总数为2 NA | |
| C. | 0.2 mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3 NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3 molH2同时有2 NA个N-H断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2vB=3vA | B. | 3vC=2vB | C. | vB=vA | D. | vC=2vB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向MgCl2溶液中加入过量的NaOH溶液,Mg2+沉淀完全,则溶液中不含Mg2+ | |
| B. | Ksp小的物质其溶解能力一定比Ksp大的物质的溶解能力小 | |
| C. | 25℃时,由于Kw(ZnS)>Kw(CuS),所以ZnS在一定条件下可转化为CuS | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com