
����Ŀ��Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�飮 ʵ��I����Ӧ����Ķ���̽��������ͼװ�ã��̶�װ������ȥ������ʵ�飺 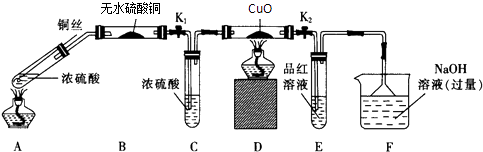
��1��Fװ�õ��ձ��з�����Ӧ�����ӷ���ʽ����Bװ���е������� ��
��2��ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�������
��3��ʵ�����ʱ����ȥ���оƾ���֮ǰ������ɵ�ʵ�������
��4��ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӵIJ��������� ʵ���Ӧ����Ķ���̽��
��5����ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣��Һ�ɫ����ΪCu2S������Cu2S�ķ�ӦΪaCu+bH2SO4 ![]() cCu2S+dCuSO4+e H2O����a��b= ��
cCu2S+dCuSO4+e H2O����a��b= ��
��6��Ϊ�ⶨ����ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00mL��Һ��ȡ����Һ25.00mL��������KI��Һ�����Ե�����ҺΪָʾ������O��36molL��1��Na2S2O3��Һ�ζ����ɵ�I2 �� 3��ʵ��ƽ�����ĸ�Na2S2O3��Һ25.00mL������Ӧ����ͭ������Ϊ6.4g��������ͭ�IJ���Ϊ �� ����֪2Cu2++4I��=2CuI+I2 �� 2S2O32��+I2=S4O62��+2I����
���𰸡�
��1��SO2+2OH��=SO32��+H2O����ɫ��ĩ����ɫ
��2��Dװ���к�ɫ������ɫ�ޱ仯��Eװ������Һ��ɫ
��3������ͭ˿���ر�K1 �� K2
��4����Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ����
��5��5��4
��6��90%
���������⣺���������£�Cu��Ũ���ᷢ��������ԭ��Ӧ��������ͭ�����������ˮ��ˮ���лӷ��ԣ��¶�Խ�ӷ���Խǿ���������ɵĶ��������к���ˮ������ˮ������ʹ��ˮ����ͭ����ɫ��Ũ���������ˮ�ԣ��ܸ�������������壻�������л�ԭ�ԣ��ܽ���ɫ������ͭ��ĩ��ԭΪ��ɫCu�������������Ư���ԣ���ʹƷ����Һ��ɫ���������������������������ж�������ֱ���ſգ������ü�����Һ���գ���1�������������������������NaOH��Ӧ�����������ƺ�ˮ�����ӷ�Ӧ����ʽΪ SO2+2OH��=SO32��+H2O��ˮ���лӷ��ԣ������¶ȴٽ���ӷ����������ɵ������к���ˮ������ˮ������ʹ��ˮ����ͭ�ɰ�ɫ��Ϊ��ɫ������Bװ���е������ǣ���ɫ��ĩ����ɫ�� ���Դ��ǣ�SO2+2OH��=SO32��+H2O����ɫ��ĩ����ɫ����2��֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�أ�����Ԫ�ػ��ϼ۱仯���ɵIJ�������жϣ�������������Dװ�û��ɫ�仯Ϊ��ɫ�������ɶ�������Eװ����Ʒ�����ɫ������֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�ʵ�������ǣ�Dװ��������ͭ��ɫ���仯��˵�����������ɣ�Eװ����Ʒ����Һ��ɫ˵�������˶����������壬
���Դ��ǣ�Dװ���к�ɫ������ɫ�ޱ仯��Eװ������Һ��ɫ����3��ʵ�����ʱ������ͭ˿����ȥ���оƾ���֮ǰ������ɵ�ʵ������ǹر�K1 �� K2 �� ��ֹCE�е���Һ������ը�Ѳ����ܣ����Դ��ǣ�����ͭ˿���ر�K1 �� K2����4����֤���ɵ���Һ�к���ͭ���ӣ���Ҫ���Թ��е�Һ�嵹��ˮ���ܽ⣬�۲��Ƿ������ɫ��Һ����Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬������ɫ��Һ֤������ͭ���ӣ�
���Դ��ǣ���Aװ������ȴ�Ļ����Һ���ձ��ڱڻ�������ʢˮ���ձ��У������Ͻ��裬�۲��Ƿ�����ɫ���֣���5��aCu+bH2SO4 ![]() cCu2S+dCuSO4+e H2O��CuԪ�ػ��ϼ���0�۱�Ϊ+1�ۡ�+2�ۡ�SԪ�ػ��ϼ���+6�۱�Ϊ��2�ۣ�ת�Ƶ�����Ϊ6������ת�Ƶ����غ㼰ԭ���غ���ƽ����ʽΪ5Cu+4H2SO4
cCu2S+dCuSO4+e H2O��CuԪ�ػ��ϼ���0�۱�Ϊ+1�ۡ�+2�ۡ�SԪ�ػ��ϼ���+6�۱�Ϊ��2�ۣ�ת�Ƶ�����Ϊ6������ת�Ƶ����غ㼰ԭ���غ���ƽ����ʽΪ5Cu+4H2SO4 ![]() Cu2S+3CuSO4+4H2O������a��b=5��4��
Cu2S+3CuSO4+4H2O������a��b=5��4��
���Դ��ǣ�5��4����6������2Cu2++4I��=2CuI+I2��2S2O32��+I2=S4O62��+2I����2Cu2+��I2��2S2O32�� ��
���Ƶõ���Һ������ͭ�����ʵ���Ũ��Ϊxmol/L��
2Cu2+��I2�� | 2S2O32�� �� |
2mol | 2mol |
0.025xmol | ��0.36��0.025��mol |
2molL��2mol=0.025xmol����0.36��0.025��mol
x= ![]() =0.36��
=0.36��
��250mL��Һ��n��Cu2+��=0.36mol/L��0.25L=0.09mol���μӷ�Ӧ��n��Cu��= ![]() =0.1mol��
=0.1mol��
������ͭ�IJ���= ![]() =90%��
=90%��
���Դ��ǣ�90%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֲ�ͬ�����ȵ�����ͭ��̿�۵Ļ������Ʒ�١��ڡ��ۣ��ס��ҡ�����ͬѧ��ȡһ����Ʒ����ǿ�ȳ�ַ�Ӧ���ⶨ����Ʒ������ͭ������
��1����ȡ��Ʒ��ǿ�ȣ������ù���Ϊ����ͭ����������������ϡ�������ȣ�����1.12L���壨��״����������Ʒ��������ͭ������Ϊg��
��2����ȡ��Ʒ��agǿ�ȣ����ɵ����岻��ʹ�����ʯ��ˮ����ǣ��ٽ���Ӧ��Ĺ�����������ϡ�����ȣ���ַ�Ӧ����bg����ʣ�࣬��ʣ�����Ļ�ѧʽΪ �� ��Ʒ��������ͭ����Ϊg ���Ժ�a��b�Ĵ���ʽ��ʾ����
��3����������Ʒ��ǿ�Ⱥ�ʣ��Ĺ��壬������ԭ��Ʒ��С��cg�����ù���Ϊ����ͭ������Ʒ��������ͭ���ʵ�����n����ȡֵ��ΧΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵������ȷ����
A. ����̼̼���ǽ���C��C��C=C֮���һ������ۼ�
B. ���顢��ϩ����ʹ����KMnO4��Һ��ɫ
C. ��������Һ�м���������Һ��ˮԡ��������������
D. ҽ�þƾ���ʹ�����ʱ��ԣ�����������ɱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¿Ƽ���������֧��ͨ����ָ
������Դ������ͨ����ͨ�š������ϡ�����Ϣ
A.�٢ڢ�B.�٢ۢ�C.�ڢۢ�D.�٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50mL 0.50mol/L�����50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ��㷴Ӧ�ȣ� 
��1���ձ���������ĭ���ϵ���������
��2����ͼ��ʾ������A������������ʵ������У���������¶ȼ��ϵ�����ˮ��ϴ�ɾ�ֱ�Ӳ���NaOH��Һ���¶ȣ����õġ�H��57.3KJ/mol�����������������=������
��3��������ϡǿ�ᡢϡǿ�Ӧ����1molˮʱ�ų�57.3kJ��������д��ϡ�����ϡ����������Һ��Ӧ���к��ȵ��Ȼ�ѧ��ʽ��
��4������ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�������ƫ����ƫС��������Ӱ�족��
��5��Ϊ�˲���ij��Ӧ���к��ȣ�����ʱ������Ҫ��������
�����Ũ�Ⱥ���� �ڼ��Ũ�Ⱥ���� �۱����� �ܷ�Ӧ����Һ������ ������ˮ�����ʵ��� ��Ӧǰ���¶ȱ仯�߲��������ʱ��
A.�٢ڢۢ�
B.�٢ۢܢ�
C.�ۢܢݢ�
D.ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ж���ȷ��ѡ����(���� )
����ʣ���ҩƷΪ�����˷�Ӧ�Ż�ԭƿ
�������Ȼ�����ҺʱҪ�ò��������Ͻ���
�۳�ȡ�׳����ҩƷʱ������ڲ��������г���
��Ũ����մ��Ƥ���ϣ������ô���ˮ��ϴ��Ȼ��Ϳ��NaOH��Һ
A. �ڢ� B. �ڢۢ� C. �ڢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ij�����һЩԪ�ض���������뵼����ϣ������ǣ� ��
A. ����Ԫ�غͷǽ���Ԫ�طֽ��߸�����Ԫ��
B. ϡ������Ԫ��
C. ���Ϸ�����ķǽ���Ԫ��
D. ���·�����Ľ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ɫ�仯������û�л�ѧ�仯��������
A.��������ŨHNO3���B.����NaCl���������ɫ����
C.ŨHNO3���ñ��D.ʯ��ˮ���ó��ֻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᴿ��ʵ���У����в�����ȷ����
A. ����ʱ�ò���������©���ڵ�Һ�壬�Լ��ٹ���
B. ��������������ʱ����Ҫ�ò���������
C. ���������г��ֽ϶ྦྷ��ʱ��Ӧֹͣ����
D. ����Һ���ɺ�ֹͣ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com