
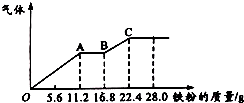
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 混合酸中H2SO4浓度为4 mol•L-1 | |
| B. | 200mL混合酸中NO3-物质的量为0.2mol | |
| C. | AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| D. | 加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4 |
分析 由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,
A.根据铁和硫酸的反应中铁的质量来确定所需硫酸的量,进而确定硫酸的浓度;
B.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
C.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
D.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸,依据3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O计算;
解答 解:A.第二份反应消耗22.4g铁,物质的量为:$\frac{22.4g}{56g/mol}$=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所原混合酸中H2SO4物质的量为0.4 mol×2=0.8mol,原混合溶液中硫酸浓度为:$\frac{0.8mol}{0.2L}$=4mol/L,故A正确;
B.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,故原混合液中n(NO3-)=2n(Fe)=2×$\frac{11.2g}{56g/mol}$=0.4mol,故B错误;
C.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故C正确;
D.最多能溶解19.2g铜的物质的量=$\frac{19.2g}{64g/mol}$=0.3mol,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知消耗氢离子物质的量为0.8mol,消耗NO3-物质的量0.2mol,依据A和B计算可知每份中硝酸物质的量0.2mol全部反应,H2SO4物质的量=4mol/L×0.1L=0.4mol,反应过程是铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸,由反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O计算得到,剩余氢离子物质的量为0.2mol,依据氢离子守恒可得到,剩余H2SO4物质的量0.1mol,故D正确;
故选B.
点评 本题以图象为载体考查混合物反应的计算,题目难度中等,据图象分析各段发生的反应原理为解答关键,注意与铁的反应中硝酸全部起氧化剂作用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ③④⑤ | C. | ③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物稳定性:CH4<NH3<H2O | B. | 第一电离能:C<N<O | ||
| C. | 电负性:C<N<O | D. | 氢化物沸点:CH4<NH3<H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al、Fe、Cu都能导电,它们的氧化物都能与酸反应 | |
| B. | 铝热反应是指铝能将所有的金属从其氧化物中置换出来 | |
| C. | CO2、NO、SO2都是非金属氧化物,都属于酸性氧化物 | |
| D. | CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的质最不再改变 | |
| B. | 物质的最浓度c(A):c(B):c(C):c(D)=m:n:p:q | |
| C. | 各组分浓度不再改变 | |
| D. | 单位时间内m molA断键,同时pmolC也断键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 事实 | 结论 |
| A | 不存在两种邻二甲苯 | 苯分子中碳碳键完全相同,而不是单双键交替结构 |
| B | 最简式相同的烃 | 要么是同系物要么是同分异构体 |
| C | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中,各元素的原子个数比一定相同 |
| D | 甲、乙两种有机物具有相同相对分子质量和不同结构 | 甲和乙一定是同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.60 | 20.62 |
| 2 | 20.00 | 0.80 | 20.78 |
| 3 | 20.00 | 0.20 | 20.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液中H+数目大于0.1NA | |
| C. | 常温下1 L 0.5mol•L-1NH4Cl溶液与2L 0.25mol•L-1NH4Cl溶液所含NH4+的数目相同 | |
| D. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
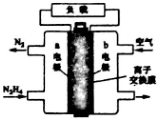 液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解溶液.下列关于该电池的叙述正确的是( )| A. | 放电时,b极附近溶液pH减小 | |
| B. | a极的反应式为N2H4+4OH--4e-═N2↑+4H2O | |
| C. | 放电时,电子从b极经过负载流向a极 | |
| D. | OH-通过阴离子交换膜向a极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com