
水是地球表面上普遍存在的化合物,我们可以用我们学习的物质结构与性质的有关知识去认识它。
(1)水的组成元素为氢和氧。氧的基态原子的价电子排布图为______________,氧的第一电离能在同周期元素中由大到小排第______位。
(2)根据杂化轨道理论,水分子中的氧原子采取的杂化形式是_______;根据价层电子对互斥理论,水分子的VSEPR模型名称为______________;根据等电子体原理,写出水合氢离子的一个等电子体(写结构式)_____________。
(3)水分子可以形成许多水合物。
①水分子可以作配体和铜离子形成水合铜离子[Cu(H2O)4]2+,1mol水合铜离子中含有σ键数目为_________。
②图1是水合盐酸晶体H5O2+·Cl-中H5O2+离子的结构。
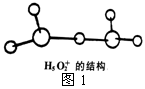
在该离子中,存在的作用力有______________。
a.配位键 b.极性键 c.非极性键 d.离子键
e.金属键 f.氢键 g.范德华力 h.π键 i.σ键
(4)韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。请从结构上解释生成暖冰的原因_________________________________。
(5)最新研究发现,水能凝结成13种类型的结晶体,除普通冰以外其余各自的冰都有自己奇特的性质:有在-30℃才凝固的超低温冰,它的坚硬程度可和钢相媲美,能抵挡炮弹轰击;有在180℃高温下依然不变的热冰;还有的冰密度比水大,号称重冰。图2为冰的一种骨架形式,依此为单位向空间延伸。
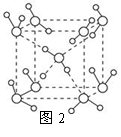
①该冰中的每个水分子有_________个氢键;
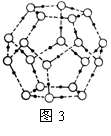
②冰融化后,在液态水中,水分子之间仍保留有大量氢键将水分子联系在一起,分子间除了无规则的分布及冰结构碎片以外,一般认为还会有大量呈动态平衡的、不完整的多面体的连接方式。右图的五角十二面体是冰熔化形成的理想多面体结构。假设图3中的冰熔化后的液态水全部形成右图的五角十二面体,且该多面体之间无氢键,则该冰熔化过程中氢键被破坏的百分比为________。
③如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰连接类似?____________;
④已知O-H…O距离为295pm,列式计算此种冰晶体的密度 g/cm3。(已知2952=8.70×104,2953=2.57×107,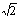 =1.41,
=1.41,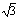 =1.73)
=1.73)
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
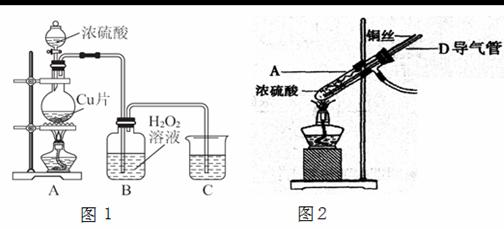 某研究性学习小组设计实验探究铜与浓硫酸的反应。
某研究性学习小组设计实验探究铜与浓硫酸的反应。
(1) 如果用图1装置进行实验:
① 装置A中反应的化学方程式_____________________________________________ 。
② 实验结束后,欲验证反应生成气体的还原性,小组同学取装置B中溶液少量于一洁净的试管中,应向试管中加入的试剂是________(填序号)。
A.品红溶液 B.稀盐酸 C.BaCl2溶液 D.稀硝酸
(2)为了更符合绿色化学的要求,该小组有同学建议用图2装置替换图1装置中的A部分进行探究实验。针对图2装置回答:
①改进后的装置符合绿色化学思想的设计是 。
②准备结束实验时立即熄灭酒精灯,B中的液体不会倒吸,其原因是 。
③拆除装置前,不打开胶塞,要使装置中残留气体完全被吸收,应当采取的操作是
。
(3)实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:a ) 氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
b ) 硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下图的实验:
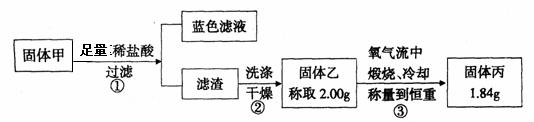
①在煅烧过程中一定发生的反应的化学方程式为 。
②下列对于固体甲成分的判断中,正确的是(填字母选项) 。
A.固体甲中,CuS和Cu2S不能同时存在 B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S D.固体甲中可能有Cu2S
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的△H不同
D.应用盖斯定律,可计算某些难以直接测量的反应焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO3(s) + CO(g)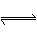 MgO(s) + CO2(g) +SO2(g) △H>0
MgO(s) + CO2(g) +SO2(g) △H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物的结构简式如下图:则此有机物可发生的反应类型有:
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和
A.①②③⑤⑥ B.②③④⑤⑥
C.①②③④⑤⑥⑦ D.②③④⑤⑥⑦
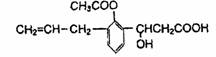
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到预期目的的是 ( )
A.将含有SO2的CO2气体通过足量的饱和Na2CO3溶液以除去SO2
B.称取19.0g氯化亚锡(SnCl2),用100mL蒸馏水溶解,配制1.0mol/LSnCl2溶液
C.用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
D.测定NaCl和NaF溶液的pH值,确定F、Cl两元素非金属性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
长效碳酸氢铵是我国自主开发的一种新型化肥,工业生产碳酸氢铵的工艺流程如下:
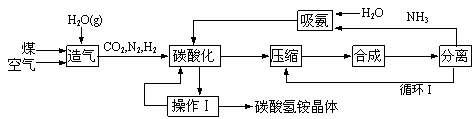 |
根据题意回答下列问题:
(1)操作Ⅰ有多步组成,包括冷却、过滤、洗涤、干燥;实验室进行过滤操作用到的玻璃仪器有___________,实验室进行该洗涤操作时宜用酒精代替水洗涤,理由是____________;
(2)分离工序是将氨从反应混合物中分离出来,其分离原理利用了氨的_________性质,设计循环Ⅰ的目的是_______________________________________;
(3)造气工序包括脱硫过程,目的是除去气体中的SO2等气体,实验室进行此操作可选用的试剂是________(填写编号);
A.NaHCO3溶液 B. NaOH溶液 C.Ca(OH)2溶液 D.Na2SO3溶液
(4)实验室实现吸氨过程可以是下列装置中的_____________(填写编号);

A. B. C. D.
(5)索尔维创建氨碱法不久后的1898年, 施莱信(Schlosing)就提出用碳酸氢铵固体与氯化钠饱和溶液作用生成碳酸氢钠再加热制纯碱的方法。写出生成碳酸氢钠的化学方程式:______________________________________; 为了进一步提纯碳酸氢钠晶体,可采用的方法有:________(填写编号);
A. 加热灼烧法 B. 重结晶法 C.酸中和法 D. 碱沉淀法
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是
A.同周期金属元素的化合价越高,其原子失电子能力越强
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,则该元素对应的气态氢化物稳定性越强
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
在做铝的燃烧实验时,用坩埚钳夹住一小块铝箔,在酒精灯上加热至其熔化,会看到的现象是铝箔熔化,失去光泽,但熔化的铝并不滴落。原因是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com