
 �ɵô𰸡�
�ɵô𰸡�


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2(g)+Cl2(g)=2HCl(g)�� ��H="-183" kJ��mol-1 |
| B��H2(g)+Cl2(g)=2HCl(g)�� ��H=+183kJ��mol-1 |
| C��H2(g)+Cl2(g)=2HCl(g)����H=-91.5kJ��mol-1 |
| D��H2(g)+Cl2(g)=2HCl(g)����H=+91.5kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���� | B���� | C���٢� | D���ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������������Һ����Һ��pH��С | B�����¶ȵ����ߣ���ˮ��pH���� |
| C��������ˮ������һ��ʱ���pH��С | D��NaOH��Һ�����ڿ����У�pH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڢۢ� | B���٢ܢ� | C���٢ڢܢޡ��� | D���٢ڢۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH ��6����Һһ�������� |
| B��c(H��)ˮ��������� c(OH��)ˮ�����������Һһ�������� |
| C��ʹʯ����Һ�Ժ�ɫ����Һһ�������� |
| D��ǿ���ǿ������ʵ�����Ϻ���Һһ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
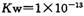 ������������ȷ����
������������ȷ����| A��700Cʱ����ˮ�м���H3PO4��,ˮ��Kw��С |
B��700C��Na2CO3��Һ��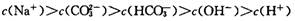 |
C��700C��H2S04��Һ��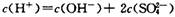 |
D����������0.1 mol/L��NaOH��Һ������700Cʱ��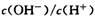 ��֮���� ��֮���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH=11��NaOH��Һ��pH=3�Ĵ�����Һ�������ϣ�����ʯ����Һ�ʺ�ɫ |
| B�����ִ�����Һ�����ʵ���Ũ�ȷֱ�Ϊc1��c2��pH�ֱ�Ϊa��a+1����c1=10c2 |
| C��pH=2��pH=1��������c(H+)֮��Ϊ10��1 |
D����0.1 mol/L�İ�ˮ�м�����������粒��壬����Һ�� ���� ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2(g)��Cl2(g)��1/2HCl(g) ���ȣ�92.4KJ/mol |
| B��H2(g)��Cl2(g)��1/2HCl(g) ���ȣ���92.4KJ/mol |
| C��H2(g)��Cl2(g)��2HCl(g) ���ȣ���184.8KJ/mol |
| D��H2(g)��Cl2(g)��2HCl(l) ���ȣ�184.8/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com