
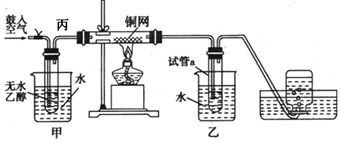
分析 (1)铜与氧气反应生成氧化铜;氧化铜与乙醇反应生成乙醛、铜和水;
(2)依据乙醇和乙醛的物理性质:二者都容易挥发.乙醇是反应物,应转化成乙醇蒸汽进入到硬质试管内参与反应;乙醛是产物,降低温度使其转化成液态,所以前者用热水浴,后者用冷水浴;
(3)乙醇被氧化为乙醛,同时生成水,反应乙醇不能完全反应,故a中冷却收集的物质有乙醛、乙醇与水;空气中氧气反应,集气瓶中收集的气体主要是氮气;
(4)能使紫色石蕊试纸变红的是酸,碳酸氢钠可以和乙酸反应,通过蒸馏方法分离出乙醛;
(5)乙醇易挥发,图中丙处导管应倾斜的原因是使冷凝的乙醇蒸汽易于回流.
解答 解:(1)铜与氧气反应生成氧化铜,方程式:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;氧化铜与乙醇反应生成乙醛、铜和水,反应的方程式:CH3CH2OH+CuO $\stackrel{△}{→}$CH3CHO+Cu+H2O
;
故答案为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CH3CH2OH+CuO $\stackrel{△}{→}$CH3CHO+Cu+H2O;
(2)根据反应流程可知:在甲处用热水浴加热使乙醇挥发与空气中的氧气混合,有利于下一步反应;乙处作用为冷水浴,降低温度,使生成的乙醛冷凝成为液体,沉在试管的底部,
故答案为:加热乙醇使其挥发与空气中的氧气充分混合,利于下一步的反应;冷却使生成的乙醛冷凝成为液体,沉在试管底部;
(3)乙醇被氧化为乙醛,同时生成水,反应乙醇不能完全反应,故a中冷却收集的物质有乙醛、乙醇与水;
空气中氧气反应,集气瓶中收集的气体主要是氮气,
故答案为:乙醛、乙醇与水;氮气;
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,实现两种互溶物质的分离用蒸馏法,
故答案为:乙酸;C;蒸馏;
(5)乙醇易挥发,图中丙处导管用倾斜的导管便于使冷凝的乙醇蒸汽易于回流,
故答案为:使冷凝的乙醇蒸汽易于回流.
点评 本题是一道考查乙醇化学性质的实验综合题,涉及有机方程式书写、对装置的理解评价、物质的分离提纯等,综合考查学生的分析能力和实验能力,题目难度中等.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| B. | 铁表面镀锌可增强其抗腐蚀性 | |
| C. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L | B. | 2 mol/L | C. | 0.5 mol/L | D. | 1.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
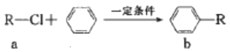 傅克反应是合成芳香族化合物的一种重要方法,有机物a和苯通过傅克反应合成b的过程表示如下(无机小分子产物略去):下列说法中不正确的是( )
傅克反应是合成芳香族化合物的一种重要方法,有机物a和苯通过傅克反应合成b的过程表示如下(无机小分子产物略去):下列说法中不正确的是( )| A. | 该反应是取代反应 | |
| B. | 若R为CH3时,a的电子式为 | |
| C. | 若R为C4H9时,b的结构可能有4种 | |
| D. | 若R为C4H20时,1 mol b最多可与5 mol H2加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com