
在2SO2(g)+O2(g)ƒ2SO3(g)反应中,反应物的消耗速率、生成物的生成速率之间的关系不正确的是( )
A.v(SO2)= v(O2)= v(SO3)
B.v(O2)= v(SO2)
C.v(SO2)=v(SO3)
D.v(SO3)=2vc(O2)
科目:高中化学 来源:2014届山西省高二8月月考化学试卷(解析版) 题型:选择题
在容器中充入SO2和只由18O原子组成的氧气18O 2,在一定条件下反应:
2SO2(g)
+O 2(g) 2SO3(g),达到平衡时, 18O存在于( )
2SO3(g),达到平衡时, 18O存在于( )
A. 只存在于O 2中
B. 只存在于O 2和SO3中
C. 只存在于SO2和SO3中
D. SO3、SO2和O 2中都有可能存在
查看答案和解析>>
科目:高中化学 来源:2012届广东省高二下学期理综)化学部分 题型:选择题
在容积不变的密闭容器中进行反应:2SO2 ( g )+O2(
g)  2SO3(g ) ;△H
< O。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g ) ;△H
< O。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
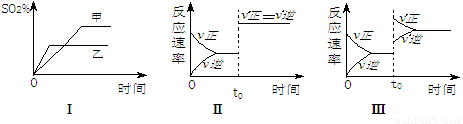
A .图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B .图Ⅱ表示t0时刻通人氦气对反应速率的影响
C .图Ⅱ表示t0时刻使用催化剂对反应速率的影响
D .图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年杭州学军中学模拟)在容积不变的密闭容器中进行反应:2SO2 ( g )+O2( g) ![]() 2SO3(g ) ;△H < O 。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是 ()
2SO3(g ) ;△H < O 。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是 ()
|
A .图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B .图Ⅱ表示t0时刻使用催化剂对反应速率的形响
C .图Ⅱ表示t0时刻通人氦气对反应速率的影响
D .图Ⅲ表示与t0时刻增大O2的浓度对反应速率的形响
查看答案和解析>>
科目:高中化学 来源:2013届山西省高二下学期期中考试化学试卷(解析版) 题型:填空题
(16分)下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
⑧ |
|
|
|
|
|
|
|
|
⑨ |
|
|
|
|
⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑨原子的外围电子排布式 。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④ 元素⑤(选填“>”、“=”、“<”)。
b.与元素④所形成的单质互为等电子体的分子、离子的化学式 、 (各写一种)。
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________________
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质。则其负极反应式为_____________________________。
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子。0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为_________________________
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。 已知该原子的半径为d pm,相对原子质量为M,NA代表阿伏加德罗常数,请回答:

晶体中该原子的配位数为 ,一个晶胞中包含的原子数目为 ;该晶体的密度为 g·cm-3(用字母表示,不必化简)。
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的物质可判断,①是H,②是Be,③是C,④是N,⑤是O,⑥是F,⑦是Mg,⑧S,⑨是Cr,⑩是Cu。
(1)因为全充满或半充满是稳定的,所以根据构造原理可知Cr的外围电子排布式3d54s1。
(2)③与①形成的水果催熟剂是乙烯,乙烯中含有碳碳双键,采用的是sp2杂化。
非金属性越强,第一电离能越大,所以N<O。氮气中含有14个电子,所以和氮气互为等电子体的分子是CO,离子是C22-。N的氢化物是氨气,N的化合价处于最低价态,被双氧水氧化生成氮气。原电池中负极失去电子,所以氨气在负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O。
(4)S和C形成的非极性的直线形分子是CS2,所以反应的热化学方程式为CS2(l)+3O2(g)===CO2(g)+2SO2(g) ΔH=-1075 kJ/mol
(5)F是最活泼的非金属元素,H和F形成的氢化物中含有氢键,从而导致测得的值一般高于理论值。
(6)铜形成的是面心立方最密堆积,其配位数是12,根据乙中的结构特点可知一个晶胞中包含的原子数目为
 8×1/8+6×1/2=4。根据丙图可知该晶胞的边长为
8×1/8+6×1/2=4。根据丙图可知该晶胞的边长为 ,所以其密度为
,所以其密度为
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:2SO2(g)+ O 2(g) ![]() 2SO3(g) △H= - 196.64kJ/mol ,在容器中充人2molSO2 和1molO2 充分反应,最终放出的热量为 ( )
2SO3(g) △H= - 196.64kJ/mol ,在容器中充人2molSO2 和1molO2 充分反应,最终放出的热量为 ( )
A.196.64kJ B.196.64 kJ·mol C.<196.64kJ D.>196.64kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com