
分析 (1)A.根据n=$\frac{V}{{V}_{m}}$计算VL氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,进而计算溶液的质量,根据V=$\frac{n}{c}$计算溶液的体积,由ρ=$\frac{m}{V}$计算溶液的密度;
B.根据c=$\frac{1000ρω}{M}$计算w,进行判断;
C.溶液质量分数=$\frac{m(氨气)}{m(氨气)+m(水)}$×100%,
D.根据n=$\frac{V}{{V}_{m}}$计算VL氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,进而计算溶液的质量,根据V=$\frac{m}{ρ}$计算溶液的体积,根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(2)根据配置一定物质的量浓度的溶液所需操作步骤和每一步操作所需仪器分析;
(3)除去KCl溶液中的SO42-,应使SO42-离子转化为沉淀,注意不能引入新的杂质.
解答 解:(1)A.VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,氨气质量为$\frac{V}{22.4}$mol×17g/mol=$\frac{17V}{22.4}$g,1L水的质量为1000mL×1g/mL=1000g,故溶液质量为(=$\frac{17V}{22.4}$+1000)g,溶液体积为:$\frac{\frac{V}{22.4}mol}{cmol/L}$=$\frac{V}{22.4c}$L,所以溶液的密度为:$\frac{\frac{17V}{22.4}g+1000g}{\frac{V}{22.4c}×1{0}^{3}mL}$=$\frac{17cV+22400c}{1000V}$g/mL,故A错误;
B.根据c=$\frac{1000ρω}{M}$可知,该氨水质量分数w=$\frac{17c}{1000ρ}$,故B正确;
C.溶液的质量分数w=$\frac{\frac{17V}{22.4}g}{\frac{17V}{22.4}g+1000g}$×100%=$\frac{17V}{17V+22400}$×100%,故C正确;
D.溶液体积为:$\frac{\frac{17V}{22.4}g+1000g}{1000ρg/L}$=$\frac{17V+22400}{22400ρ}$L,氨气的物质的量浓度c=$\frac{\frac{V}{22.4}mol}{\frac{17V+22400}{22400ρ}L}$=$\frac{1000Vρ}{17V+22400}$mol/L,故D正确;
故答案为:BCD;
(2)配制一定物质的量的浓度的溶液需要称量、溶解、洗涤、移液、定容等操作,溶解需要烧杯、玻璃棒,定容需要胶头滴管、需要100mL容量瓶进行配制,
故答案为:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(2)除去KCl溶液中的SO42-,应先加入过量BaCl2使SO42-生成沉淀,然后加入K2CO3使过量的BaCl2生成沉淀,过滤后加入HCl除去过量的K2CO3,所以依次加入溶液为:BaCl2、K2CO3、HCl,
故答案为:BaCl2、K2CO3、HCl.
点评 本题考查物质的量及其浓度的计算、物质的分离、提纯的基本方法选择与应用,题目难度中等,明确物质的量与物质的量浓度、摩尔质量等物理量之间的关系为解答关键,注意根据混合物组分性质的差异性选择分离的方法,本题易错点为(3),注意加入试剂的顺序和除杂原理.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| B. | 60 g乙酸分子中含σ键总数为6NA | |
| C. | 1.0L的0.1 mol•L-1Na2S溶液中含有的S2-离子数为0.1NA | |
| D. | 常温下,35.5g Cl2与足量的NaOH溶液充分反应,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 6:3:2 | C. | 4:3:2 | D. | 6:4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、S、NOX等进行研究具有重要意义.为减少SO2的排放,常采取的措施是:将煤转化为清洁气体燃料.涉及的化学反应为:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、S、NOX等进行研究具有重要意义.为减少SO2的排放,常采取的措施是:将煤转化为清洁气体燃料.涉及的化学反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,燃烧1mol S吸收的热量为297.23 kJ | |
| B. | S (g)+O2 (g)═SO2 (g) 放出的热量大于297.23 kJ | |
| C. | S (g)+O2 (g)═SO2 (g)放出的热量小于297.23 kJ | |
| D. | 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS (s)和 1mol O2 (g)的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10s | B. | 8s | C. | 大于10s | D. | 小于10s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
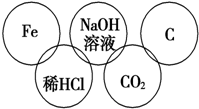 小美在五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请完成下列问题:
小美在五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | API含义是空气污染指数,它是衡量空气质量好坏的指标,数值越大,空气质量就越好 | |
| B. | 空气质量级别分为5级,5级为优,1级为重度污染 | |
| C. | 正常雨水的PH=7 | |
| D. | SO2是形成酸雨的主要物质之一,主要来源于化石燃料的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O所含质子数为10NA | |
| B. | 在标准状况下,0.5NA个氯气分子所占的体积约是11.2L | |
| C. | 标准状况下,22.4 L汽油所含的分子数为NA | |
| D. | 1克氢气所含原子数约为6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com