
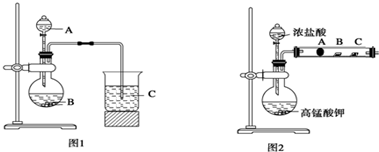
分析 (1)元素的非金属性越强,其最高价含氧酸的酸性越强,验证元素非金属性,由图可知应是利用最高价含氧酸的酸性强弱比较,固体B为大理石,则试剂A为某元素的最高价含氧酸;
(2)图1烧瓶中硝酸与碳酸钙反应生成硝酸钙和二氧化碳、水;
(3)C中应盛装硅酸钠溶液,以此来证明碳酸、硅酸的酸性强弱,碳酸酸性比硅酸强;
(4)单质的氧化性Cl2>Br2>I2,则B处氯气通过湿润的淀粉KI试纸,生成I2;
(5)浓盐酸和高锰酸钾在常温下发生氧化还原反应生成氯气,非金属性Cl>Br>I,单质的氧化性Cl2>Br2>I2,卤素单质之间可发生置换反应;
(6)通过B处的气体主要是氯气,氯气能氧化碘离子,不能证明氧化性Br2>I2.
解答 解:(1)元素非金属性与对应最高价含氧酸之间的关系,元素的非金属性越强,其最高价含氧酸的酸性越强,用如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较,B为大理石,则试剂A为某元素的最高价含氧酸,四种溶液中只有①稀硝酸为氮元素的最高价含氧酸,所以试剂A为硝酸,用硝酸制取二氧化碳,用二氧化碳与硅酸钠反应制硅酸,
故答案为:①;
(2)图1烧瓶中硝酸与碳酸钙反应,生成硝酸钙和二氧化碳、水,因为碳酸钙难溶于水,写化学式,硝酸是强酸,拆写成离子,因此烧瓶中反应的离子方程式是:2H++CaCO3=Ca2++CO2↑+H2O,
故答案为:2H++CaCO3=Ca2++CO2↑+H2O;
(3)C中应盛装硅酸钠溶液,以此来证明碳酸、硅酸的酸性强弱,由于碳酸酸性比硅酸强,在C中通入二氧化碳气体生成硅酸沉淀,因此烧杯中反应的离子方程式是:CO2+SiO32-+H2O=H2SiO3↓+CO32-,H2SiO3是白色胶状沉淀,
故答案为:出现白色沉淀;
(4)单质的氧化性Cl2>Br2>I2,则B处氯气通过湿润的淀粉KI试纸,氯气与KI反应Cl2+2KI═2KCl+I2,生成碘单质,碘遇淀粉变蓝色,
故答案为:湿润的淀粉KI试纸变蓝;
(5)单质的氧化性Cl2>Br2>I2,A处氯气通过沾有NaBr溶液的棉花,发生置换反应生成溴,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
(6)通过B处的气体主要是氯气,氯气能氧化碘离子,所以淀粉KI试纸变蓝色,是因为B处氯气通过湿润的淀粉KI试纸,氯气与KI反应Cl2+2KI═2KCl+I2,生成碘单质,所以不能证明Br2>I2,
故答案为:通过B的气体主要是Cl2,即不能说明氧化性Br2>I2.
点评 本题考查探究元素周期律实验方案设计,综合运用元素及其化合物、元素周期律与非金属性强弱比较的有关知识是解答关键,具有较强的综合性,注意实验设计的原理和方法,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 在高温条件下进行反应 | B. | 在有氧条件下进行反应 | ||
| C. | 按化学式计量投入原料 | D. | 隔绝氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
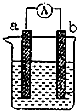 图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
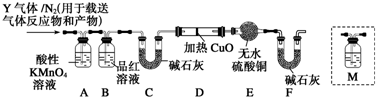
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 设锌镀层厚度为h,锌的密度为ρ,则h=$\frac{{m}_{1}-{m}_{2}}{ρs}$ | |
| B. | 锌电极的电极反应式为2H2O+2e-═H2↑+2OH- | |
| C. | 锌和石墨在碱溶液中形成原电池,外电路中电流从锌流向石墨 | |
| D. | 当石墨上不再有气泡时,立即取出铁片,冲洗后用酒精灯加热烘干,铁片可能部分被氧化,导致实验结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含11个质子、12个中子、10个电子的粒子 | |
| B. | 含18个质子、22个中子、18个电子的粒子 | |
| C. | 含17个质子、18个中子、17个电子的粒子 | |
| D. | 含17个质子、20个中子、18个电子的粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
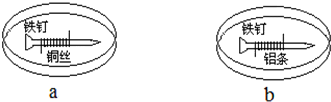
| A. | a中铁钉附近呈现红色 | B. | b中铁钉上发生还原反应 | ||
| C. | a中铜丝上发生还原反应 | D. | b铁钉上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化钠溶液中加入足量硝酸银溶液:Ag++Cl-=AgCl↓ | |
| D. | 氯化铁溶液中加入氢氧化钠溶液:Fe3++3OH-=Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
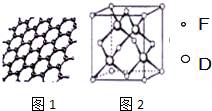 原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.
原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com