
右图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )
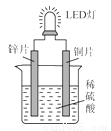
A.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B.如果将锌片换成铁片,电路中的电流方向将改变
C.其能量转化的形式主要是“化学能→电能→光能”
D.如果将稀硫酸换成柠檬汁,LED灯将不会发光
科目:高中化学 来源:2015-2016学年湖北省枣阳市高二下期中化学试卷(解析版) 题型:选择题
如图所示,Na?S电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
2Na(l)+S8(l)  Na2Sn。下列说法不正确的是
Na2Sn。下列说法不正确的是

A.外室熔融硫中添加石墨粉主要是为了增强导电性
B.放电时Na+向正极移动
C.充电时阳极反应式为8S-16e-===nS8
D.充电时钠极与外接电源的正极相连
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省宜昌市高二下期中化学试卷(解析版) 题型:选择题
只用一种试剂就能将甲苯、环己烯、四氯化碳、碘化钾溶液区分开来,该试剂可以是
A.溴化钾溶液 B.溴水 C.高锰酸钾溶液 D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省宜昌市高二下期中化学试卷(解析版) 题型:选择题
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂一KNO3的U型管)构成—个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极;②正极反应为:Ag++e-=Ag;
③实验过程中取出盐桥,原电池仍继续工作;④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省襄阳市高一下期中化学试卷(解析版) 题型:填空题
2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.2F2+2H2O=4HF+O2 B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑ D.3Fe+4H2O Fe3O4+4H2]
Fe3O4+4H2]
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省襄阳市高一下期中化学试卷(解析版) 题型:选择题
在四个不同容器中,不同条件下进行合成氨反应.根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A.v(N2)=0.1mol•L﹣1•s﹣1 B.v(H2)=0.1mol•L﹣1•min﹣1
C.v(NH3)=0.15mol•L﹣1•min﹣1 D.v(H2)=0.3mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省襄阳市高一下期中化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二下期中化学试卷(解析版) 题型:填空题
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g)△H1=—99kJ.mol-1,
CH3OH(g)△H1=—99kJ.mol-1,
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2=—58kJ.mol-1
CH3OH(g)+H2O(g)△H2=—58kJ.mol-1
③CO2(g)+H2(g) CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)写出CO2的结构式__________。
(2)由上述数据计算出△H3=kJ.mol-1
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,温度T1、T2对反应的影响,下列正确的是__________(填序号)
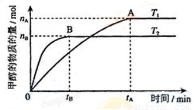
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tAmol/(L·min)
②该反应在T1时的平衡常数比T2时的小
③当生成1mol甲醇的同时,生成1molCO2,说明反应达到平衡
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;该温度条件下,反应平衡常数为__________(计算出结果)
(5)在直接以甲醇为燃料电池中,电解质溶液为硫酸性,负极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高一下期中化学卷(解析版) 题型:选择题
下列关于元素周期表和元素周期律的说法错误的是( )
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com