
| A、书写热化学方程式时任何反应条件都不能标注 |
| B、热化学方程式中的化学计量数表示物质的量,可以是分数 |
| C、任何酸与碱发生中和反应,生成1 mol H2O时放出的热量叫做中和热 |
| D、101KPa时,1 mol H2与在足量 O2中燃烧放出的热量就是H2的燃烧热 |


科目:高中化学 来源: 题型:
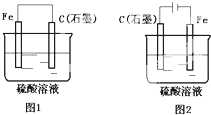 如图是化学能与电能相互转换的两套装置.对此两套装置的分析正确的是( )
如图是化学能与电能相互转换的两套装置.对此两套装置的分析正确的是( )| A、两装置中,铁电极上均有气体产生 |
| B、两装置中,石墨电极上均有气体产生 |
| C、石墨电极上发生的电极反应均为:2H++2e-=H2↑ |
| D、随着反应的进行,两装置中电解质溶液的酸性均减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,13.8g NO2气体溶于足量水,转移电子数为0.2NA |
| B、标准状况下,22.41.CH3CI含有的原子数为5NA |
| C、0.5mo1O2与11.2LO2所含的分子数一定相等 |
| D、常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、25℃1.01×105Pa?64克SO2中含有的原子数为3NA |
| C、22.4LCH4与18gH2O所含有的电子数均为10NA |
| D、CO和N2分子含有的电子数相同,22.4L的CO气体与lmol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12g/mol |
| B、32g |
| C、80g/mol |
| D、32g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

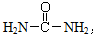 ,请写出尿素的同分异构体中含有离子键的化学式
,请写出尿素的同分异构体中含有离子键的化学式| 一定条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com