
【题目】“漂粉精”Ca(ClO)2与密度为1.19g·cm-3质量分数为36.5%的HCl溶液反应生成Cl2,该化学方程式为:Ca(ClO)2 + 4HCl(浓)= CaCl2 + 2Cl2↑ + 2H2O
(1)浓盐酸在反应中显示出来的性质是____________ (填写字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)用双线桥法表示该氧化还原反应中电子转移情况_________________。
(3)标准状况下若产生4.48L Cl2,则反应过程中被氧化的HCl的物质的量是___。
(4)某同学欲用该浓盐酸配制100mL1mol·L﹣1HCl溶液.回答下列问题:
①需取用该浓盐酸体积为________。
②配制1mol·L﹣1HCl溶液时需用的主要仪器有烧杯、量筒、玻璃棒、胶头滴管、___。
③不规范的实验操作会导致实验结果的误差.分析下列操作对实验结果的影响偏小的是__。(请填序号)
A.容量瓶中原有少量蒸馏水 B.定容时俯视刻度线
C.玻璃棒在刻度线上方引流溶剂水 D.颠倒摇匀后发现凹液面低于刻度线但没加水
【答案】 B 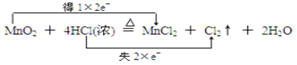 0.2 mol 8.4mL 100mL容量瓶 C
0.2 mol 8.4mL 100mL容量瓶 C
【解析】本题主要考查一定物质的量浓度溶液的配制方法。
(1)浓盐酸中Cl-一半被氧化,另一半保留,所以浓盐酸在反应中显示出来的性质是还原性和酸性,故选B。
(2)用双线桥法表示该氧化还原反应中电子转移情况: 。
。
(3)标准状况下若产生4.48L即0.2molCl2,Cl2来自于被氧化的HCl,则反应过程中被氧化的HCl的物质的量是0.2mol。
(4)①c浓=![]() =
=![]() ==11.9mol/L,c浓V浓= c稀V稀,V浓=8.4mL,故需取用该浓盐酸体积为8.4mL。
==11.9mol/L,c浓V浓= c稀V稀,V浓=8.4mL,故需取用该浓盐酸体积为8.4mL。
②配制1mol·L﹣1HCl溶液时需用的主要仪器有烧杯、量筒、玻璃棒、胶头滴管、100mL容量瓶。
③A.对实验结果没有影响;B.所配溶液体积变小,对实验结果的影响偏大;C.刻度线上方残留溶剂水,所配溶液体积变大,对实验结果的影响偏小;D.对实验结果没有影响。故选C。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】下列有关含高能量的正离子N5+的化合物N5AsF6的叙述正确的是( )
A.N5+与H2S是等电子体
B.N5AsF6化合物是共价分子
C.N5+中氮氮原子间以共用电子对结合
D.N5AsF6化合物是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. FeCl3溶液腐蚀印刷电路铜板:Cu+Fe3+=Cu2++Fe2+
B. 醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O
C. 在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
D. 在NaHCO3溶液中滴入少量澄清石灰水:HCO![]() +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将 0.10 molL-1的NaOH溶液逐滴滴入到20.00 mL 0.10 mol L-1醋酸溶液中,溶液中的pH曲线与NaOH溶液体积的关系如图所示:

下列有关判断错误的是( )
A. 该温度下,醋酸的Ka的数量级为l0-5 B. N点对应的NaOH溶液体积可能为20.0mL
C. 溶液中,水的电离程度N点比Q点大 D. R点所示溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
(1)负极材料是_______(写名称),电极反应式为________。
(2)正极电极反应式为_____________
(3)溶液中SO42-向______极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
锂一磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+CuSO4+2NH3·H2O= Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的电子排布式:_______________。
(2)PO43-的空间构型是___________________。
(3)P、S元素第一电离能大小关系为_____________________。
(4)氨基乙酸铜分子结构如图,碳原子的杂化方式为_____________,基态碳原子核外电子有
个空间运动状态。

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol该配合物含有的π键的数目
为____________________。
(6)铜晶体密堆积方式如图所示,铜原子的配位数为_______________,铜的原子半径为127.8pm,NA表示阿伏伽德罗常数的值,列出晶体铜的密度计算式________________g·cm-3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com