
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.pH=1的溶液中:Fe2+、ClO-、Na+、SO42- |
| B.在含较多Al3+的溶液中:K+、Cl-、HCO3- |
| C.NH4HSO4溶液与过量NaOH稀溶液反应:NH4++OH-=NH3?H2O |
| D.向小苏打溶液中加入NaOH固体:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.饱和石灰水跟稀硝酸反应Ca(OH)2 + 2H+ = Ca2+ + 2H2O |
| B.钠和水反应Na+2H2O=Na++H2↑+2OH- |
| C.大理石与盐酸反应 CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.硫酸与氢氧化钡溶液反应 Ba2++OH-+H++SO42-= BaSO4↓+ H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- |
| B.含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ |
| C.含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 |
| D.含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+ | B.Fe2+ | C.Al3+ | D.NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
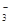 、SO
、SO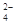 、NH
、NH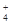 、CO
、CO (不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com