
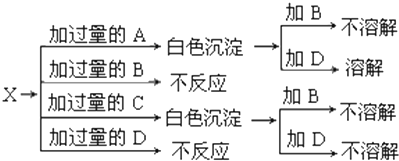
 如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.
如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
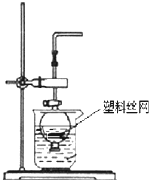 用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )
用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )| A、用块状大理石与稀硫酸反应制取CO2 |
| B、用锌粒与稀硫酸反应制取H2 |
| C、用过氧化钠与水反应制取O2 |
| D、用二氧化锰与浓盐酸反应制取Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、存放W单质的仓库失火不能用CO2灭火 |
| B、Z的氧化物通常形成分子晶体 |
| C、Y的单质能把溴从溴化物中置换出来 |
| D、X的氢化物可以是两种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| B、氯气与KOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| C、盐酸与AgNO3溶液反应:HCl+Ag+=H++AgCl↓ |
| D、NaCl溶液与AgNO3溶液反应:Cl-+Ag+=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- |
| B、Fe和稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ |
| C、FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ |
| D、用醋酸除水垢 2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b>c>d |
| B、b>a=d>c |
| C、a=b>d>c |
| D、c>a=d>b |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com