
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:分析 (1)根据装置A反应的离子方程式SO2+2Fe3++2H2O═2Fe2++SO42-+4H+进行解答;
(2)实验室制取气体要考虑操作方便、易控制、不能含杂质;
(3)二氧化硫具有刺激性气味,污染空气,用氢氧化钠溶液吸收二氧化硫,防止空气污染;
(4)根据蒸发、冷却结晶、过滤等基本操作判断所用的仪器;
(5)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,根据还原剂的还原性大于还原产物的还原性分析.
解答 解:(1)二氧化硫与铁离子反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,反应中铁离子被氧化成亚铁离子,所以还原产物为亚铁离子,参加反应的SO2和Fe3+的物质的量之比是1:2,
故答案为:Fe2+;1:2;
(2)A.硝酸具有强氧化性,能够将亚硫酸钠氧化成硫酸钠,无法得到二氧化硫气体,故A错误;
B.浓硫酸虽具有强酸性,且浓硫酸不挥发,亚硫酸钠溶液与浓硫酸能够反应生成二氧化硫气体,故B正确;
C.固体硫在纯氧中燃烧,操作不容易控制,且无法获得纯净的二氧化硫,故C错误;
D.Cu与浓硫酸在加热条件下生成二氧化硫、硫酸铜和水,可知制备二氧化硫,故D正确;
故答案为:BD;
(3)二氧化硫气体是酸性氧化物,具有刺激性气味,直接排放会污染大气,由于二氧化硫能和碱反应生成盐和水,可用碱液处理二氧化硫,所以装置C的作用为:吸收SO2尾气,防止污染空气,
故答案为:吸收二氧化硫尾气,防止污染空气;
(4)溶液中得到绿矾的实验操作是蒸发浓缩,冷却结晶,过滤洗涤,干燥步骤得到,所以在这一系列操作中没有用到的仪器有石棉网、坩埚,
故答案为:B、F;
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,反应的离子方程式为5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,所以方案①不合理,
故答案为:方案①;5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-;
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,其反应的离子方程式为:I2+SO2+2H2O=4H++2I-+SO42-;
故答案为:装置B中溶液蓝色褪去;I2+SO2+2H2O=4H++2I-+SO42-.
点评 本题考查了物质性质实验方案的设计,题目难度中等,试题涉及氧化性还原性强弱比较、性质实验方案的设计与评价等知识,明确掌握浓硫酸的性质、二氧化硫的检验方法等知识为解答本题关键.


科目:高中化学 来源: 题型:解答题
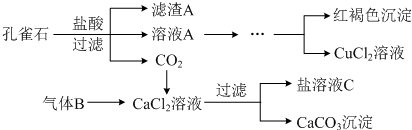
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
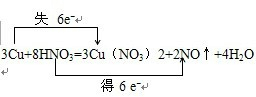 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ⑥ | C. | ①②③④⑤⑦⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小 | B. | 逆反应速率减小,正反应速率增大 | ||
| C. | 逆反应速率先增大后减小 | D. | 正反应速率先减小后增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
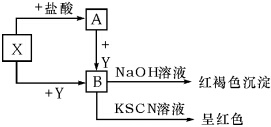 常见金属X,有下列关系图,根据图示回答:
常见金属X,有下列关系图,根据图示回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com