
【题目】铜锌原电池(如图)工作时,下列叙述正确的是

A. 正极反应为:Zn-2e-=Zn2+
B. 一段时间后铜片增重,盐桥中K+移向CuSO4溶液
C. 电流从锌片经导线流向铜片
D. 电池工作时Zn2+和Cu2+的浓度保持不变
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】CO、CO2是含碳元素的常见气体,也是参与碳循环的重要物质。
(1)利用煤化工中产生的CO和H2可制取甲醇,反应为CO(g)+2H2(g)![]() CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的物质的量(单位:mol)如下表所示:
CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的物质的量(单位:mol)如下表所示:
10min | 20min | 30min | 40min | 50min | 60min | |
300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
①300℃和500℃对应的平衡常数大小关系为K300℃_________K500℃(填“>”、“=”或“<”)。
②在一定条件下,下列描述中能说明上述反应已达平衡的是_______(填标号)。
A.容器内气体的平均摩尔质量保持不变
B.2v(H2)正=v(CH3OH)逆
C.容器中气体的压强保持不变
D.单位时间内生成nmolCO的同时生成2nmolH2
③300℃时,前10min内,该反应的平均反应速率为v(H2)=_________mol/(L·min)。
④下列措施能够增大此反应中CO的转化率的是_________(填标号)。
A.充入CO气体B.升高温度
C.使用优质催化剂D.往容器中再充入1molCO和2molH2
⑤500℃时,保持反应体系的温度不变,60min时再向容器中充入CH3OH气体和H2各0.4mol,反应将向____________________(填“正反应方向”、“逆反应方向”或“不”)进行。再次达到平衡时的平衡常数为____________L2/mol2。
(2)二氧化碳催化加氢也可合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H。在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如下图所示.
CH3OH(g)+H2O(g)△H。在密闭容器中投入1molCO2和2.75molH2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化如下图所示.
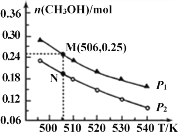
①二氧化碳合成甲醇正反应的△H______0(填“>”、“<”或“=”,下同)。
②M、N两点时化学反应速率:v(N)______v(M)。
(3)一定条件下,向容积不变的某密闭容器中加入amolCO2和bmolH2发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的大小关系式是_________。
CH3OH(g)+H2O(g),欲使整个反应过程中CO2的体积分数为恒定值,则a与b的大小关系式是_________。
(4)以TiO2/Cu2Al2O4为催化剂,可以将COspan>2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。当乙酸的生成速率主要取决于温度时,其影响范围是_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
II | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2<T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:

容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,分别进行不同条件下的合成氨反应N2(g)+3H2(g)![]() 2NH3(g)。在相同时间内表示该反应速率最快的是
2NH3(g)。在相同时间内表示该反应速率最快的是
A. v(H2)=0.1mol/(Ls) B. v(N2)=0.1mol/(Ls) C. v(N2)=0.2mol/(Ls) D. v(NH3)=0.3mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是

A. a点表示溶液中c(H+)=10-3 mol/L
B. b点表示的溶液中c(CH3COO-)>c(Na+)
C. c点表示CH3COOH和NaOH恰好反应完全
D. a、b点表示的溶液中c(CH3COO-).c(H+)/c(CH3COOH)均等于K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
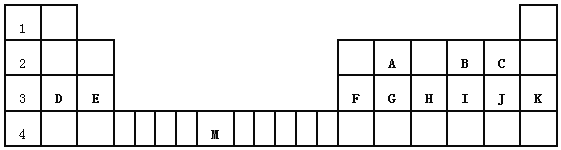
(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
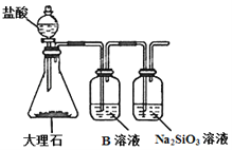
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺流程如下:
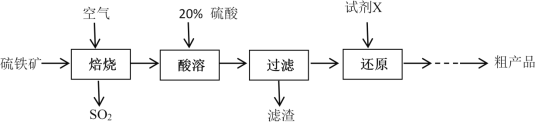
回答下列问题:
(1)焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____________________
(2)试剂X是(写化学式)__________________
(3)设计实验检验还原得到的溶液是否达标:_________________________________________
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的操作是_______________________
(5)可以用标准浓度的酸性KMnO4溶液来测定产品中FeSO4的纯度,反应中KMnO4被还原成Mn2+。反应的离子方程式为 __________________________________
(6)某种工业品中含有FeSO4和Fe2(SO4)3。通过元素分析得知其中铁元素和硫元素的物质的量之比n(Fe)︰n(S) =1︰1.2 ,此工业品中FeSO4的物质的量分数为___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、A1(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断中不合理的是( )

A. N一定是HCl(aq)B. X可能是Al或Cl2
C. Q、Z中的一种必定为A12O3D. Y一定为NaOH(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com