
分析 发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(NaOH)=0.5L×1mol/L=0.5mol,n(H2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合反应计算.
解答 解:n(NaOH)=0.5L×1mol/L=0.5mol,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,n(Al)=0.5mol,其质量为0.5mol×27g/mol=13.5g;
若产生标准状况下11.2L的H2,转移电子为0.5mol×2×(1-0)=1mol,
答:消耗Al为13.5g,若产生标准状况下11.2L的H2,转移1mol电子.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应或电子转移计算为解答的关键,侧重分析与计算能力的考查,注意利用化合价变化计算转移电子,题目难度不大.


科目:高中化学 来源: 题型:选择题
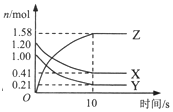 在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )
在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )| A. | 反应开始到10s时,转化率:Y>X | |
| B. | 若前10s容器内的压强增加,说明生成Z的反应为放热反应 | |
| C. | 由图象可知前10s内生成Z的速率越来越快 | |
| D. | 若X为紫色,Y、Z无色,则10s后混合气体颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
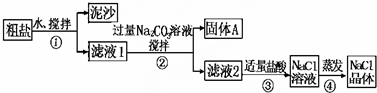
| 猜想 | 验证的操作 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含有BaCO3 | 取少量固体A于试管中,先滴入过量稀硝酸(或稀盐酸),再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想Ⅱ不成立 |
| 猜想Ⅱ:最后制得的NaCl晶体中还有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, 先滴入BaCl2溶液,再滴入过量稀HNO3 | 有白色沉淀 | 猜想Ⅱ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
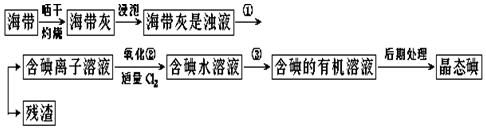
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C 与 14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3 与 CH3CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
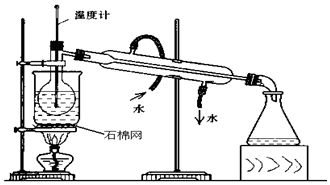
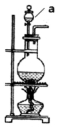 欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物.某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水.
欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物.某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com