
| A、反应②在任何温度下均能自发进行 |
| B、CO(g)+2H2(g)=CH3OH(g)△H>-90.5 mol?L-1 |
| C、甲醇的标准燃烧热为△H=-764 kJ?mol-1 |
| D、若CO的标准燃烧热为△H=-282.5 kJ?mol-1,则H2标准燃烧热为△H=-286 kJ?mol-1 |
| 1 |
| 2 |
| 1 |
| 2 |
| (③×2-①)-②×2 |
| 4 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、0.225mol/L |
| B、0.30mol/L |
| C、0.36mol/L |
| D、0.45mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、3 mol/L |
| B、8.4 mol/L |
| C、11.8 mol/L |
| D、0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入KSCN溶液和盐酸,溶液变红色 | 证明原溶液一定含Fe3+ |
| B | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑 浊的无色无味气体 | 证明原溶液一定含CO32- |
| C | 将氯水滴入品红溶液,品红溶液褪色. | 证明氯气与水反应的产物有漂白性 |
| D | 用砂纸打磨过的铝箔在空气中受热熔化,并不滴落 | 证明Al2O3熔点一定高于Al单质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
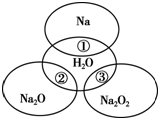 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A、Na2O2中阴阳离子数目之比为1:1 |
| B、反应①的离子方程式为Na+2H2O═Na++2OH-+H2↑ |
| C、反应③最多能转移0.1 mol电子 |
| D、①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com