
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。

(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去)。
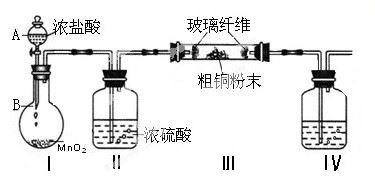
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③如果浓盐酸不能顺利滴下,可能的原因是 。
④装置Ⅳ中盛装的试剂是 ,其作用是 。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
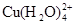 (aq) +4Cl-(aq)
(aq) +4Cl-(aq)
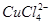 (aq) +4H2O(l)
(aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a. b 。
(3)由CuCl2溶液得到CuCl2·2H2O的过程中要加入盐酸的目的是 。
科目:高中化学 来源:2014高考名师推荐化学微粒的组成、结构及性质(解析版) 题型:选择题
两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有
A.1对 B.2对 C.3对 D.4对
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下:
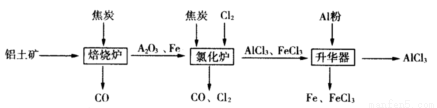
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为_______。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为 。充分反应后温度降至_____以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式________,与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al): m(Pb)=__________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验药品保存、基本操作、检验(解析版) 题型:选择题
下列操作不能达到目的的是
选项 | 目的 | 操作 |
A | 配制100mL1.0mol/L CuSO4溶液 | 将25gCuSO4·5H2O溶于100mL蒸馏水中 |
B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:填空题
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
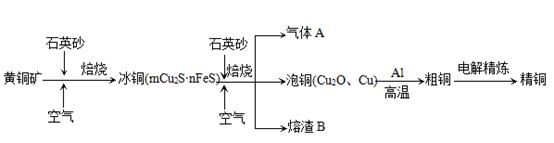
(1)气体A中的大气污染物可选用下列试剂中的_______
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学守恒及离子浓度大小的比较(解析版) 题型:选择题
下列物质的量浓度关系错误的是
A.等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHCO3溶液:c(Na+)>c(OH-)>c( )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学守恒及离子浓度大小的比较(解析版) 题型:选择题
常温下,向20.00 mL 0.100 0 mol·L-1CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是
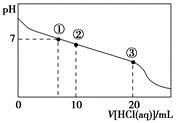
A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH>c(CH3COO-) )>c(H+)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学周期表、核素(解析版) 题型:选择题
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A 体积相等时密度相等
B 原子数相等时具有的中子数相等
C 体积相等时具有的电子数相等
D 质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学键与分之间作用力(解析版) 题型:选择题
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法中正确的是
A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
B.化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键
C.用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀
D.X、Z两元素能形成原子个数比为3∶1和4∶2的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com