
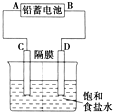
 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
| ||
| ||
| ||
| 40a | ||
1000×1.15-
|
| 40a | ||
1000×1.15-
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COOH)>c(CH3COO-) |
| C、2c(H+)=c(CH3COO-)-c(CH3COOH) |
| D、c(CH3COOH)+c(CH3COO-)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH相等的①NH4Cl ②(NH4) 2SO4③NH4HSO4的溶液中,c(NH4+)大小:①>②>③ |
| B、向1.00L0.3mol?L-l的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中:3c (Na+)=2[c(HCO3-)+C (CO32-)+c(H2CO3)] |
| C、浓度均为0.1 mol?L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c (CH3COOH)=c (H+)-c(OH-) |
| D、常温下,在l0mL pH=12的氢氧化钠溶液中加入pH=2的HA酸至pH刚好等于7,所得溶液体积V(总)≤20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl |
| B、H2SO4 |
| C、CuCl2 |
| D、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解开始时,阴极有H2放出 |
| B、电解开始时,阳极上发生:Cu2++2e-═Cu |
| C、当电路中通过电子的量超过0.1mol时,阴极放电的种类将发生变化 |
| D、整个电解过程中,SO42-不参加电极反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 |
| B、漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 |
| C、欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| D、氯水经光照有气泡逸出,该气体为HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com