
将4 mol X气体和2 mol Y气体在2 L的容器中混合,并在一定条件下发生如下反应:2X(g)+Y(g)  2Z(g),若经2 s后所测得Z的浓度为0.6 mol·L-1,回答以下问题。
2Z(g),若经2 s后所测得Z的浓度为0.6 mol·L-1,回答以下问题。
(1)求0~2 s用X物质表示的平均反应速率为___________________________________。
(2)求物质Y在2 s时的转化率_____________________。
(3)若上述反应是在甲、乙、丙三个相同的密闭容器中进行反应,经同一段时间后,测得三个 容器中的反应速率分别为
容器中的反应速率分别为
甲:v(X)=0.2 mol·L-1·s-1;
乙:v(Y)=0.12 mol·L-1·s-1;
丙:v(Z)=9.6 mol·L-1·min-1;
则用上述速率表示该反应由快到慢的顺序为________________________________________________。
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
某不纯的烧碱样品中各成分的质量分数如下表所示:
| 成分 | NaOH | Na2CO3 | H2O |
| 质量分数 | 90.4% | 3.8% | 5.8% |
取a g样品溶于100mL2mol/L的盐酸中,充分反应后,再用适量3mol/LNaOH溶液将剩余的酸恰好中和,最后将溶液蒸干,可得干燥固体的质量为
A.11.7 g B.5.85 g C.2.34 g D.(2.34- a) g
查看答案和解析>>
科目:高中化学 来源: 题型:
将11.5 g钠、9 g铝、28 g铁分别投入200 mL 1 mol·L-1的盐酸中,结果正确的是( )
A.钠与盐酸反应最剧烈,产生的气体最多
B.铝与盐酸反应的速率仅次于钠,但产生的气体最多
C.铁与盐酸反应产生的气体比钠多
D.反应结束时产生的气体一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
饮用水中的NO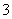 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO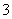 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO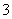 还原为N2,其化学方程式为:Al + NaNO3 + NaOH — NaAlO2 + N2↑+ H2O (未配平)。请回答下列问题:
还原为N2,其化学方程式为:Al + NaNO3 + NaOH — NaAlO2 + N2↑+ H2O (未配平)。请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)配平上述反应:
Al + NaNO3 + NaOH = NaAlO2 + N2↑+ H2O
(3)用“双线桥法”表示反应中电子转移的方向和数目:
___________________________________________________________。
(4)上述反应中若标准状况下产生11.2 L气体物质,则转移电子的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )

A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定,H2O2为二元弱酸,其酸性比碳酸弱,它在碱性溶液中极不稳定,易分解生成H2O和O2。若向Na2O2中通入干燥的CO2气体,Na2O2与CO2并不起反应。
(1)写出H2O2在水溶液中的电离方程式
(2)用化学方程式表示Na2O2和潮湿的CO2气体反应的过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
请回答下列问题:
(1)T的原子结构示意图为 .
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 .
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 .
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 .
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ.又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H= (注:题中所涉单质均为最稳定单质).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com