
下列物质与其用途完全符合的有( )
①Na2CO3—制玻璃; ②SiO2—太阳能电池; ③Na2SiO3—木材防火剂; ④NH3—制冷剂;
⑤Al2O3—焊接钢轨; ⑥NaClO—消毒剂、漂白织物 ⑦Fe2O3—红色油漆或涂料
A.4个 B.5个 C.6个 D.7个
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:2016届辽宁省高三上学期第二次模拟测试化学试卷(解析版) 题型:选择题
元素X、Y、Z、W的原子序数依次增大,且原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足相应稳定结构。下列说法正确的是
A.X、Y、Z、W的原子半径的大小关系为:W> Y >Z> X
B.在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等
C.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
D.X、Y、Z、W四种元素可形成化学式为Y2X7ZW2的化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高一上期中考试化学试卷(解析版) 题型:选择题
下列实验操作中正确的是
A.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释
B.玻璃导管蘸水后,边旋转边向橡皮管中插入
C.用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将胶头滴管尖嘴处伸入试管中
D.称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
已知电极上每通过96 500 C的电量就会有1 mol电子发生转移。精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中,常用银电量计,如图所示。下列说法不正确的是( )
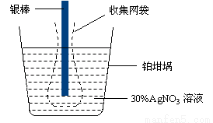
A.电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是:Ag++e-=Ag
B.称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0mg,则电解过程中通过电解池的电量为96.5C
C.实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会偏高。
D.若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁沈阳市高三上学期期中考试化学试卷(解析版) 题型:实验题
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究
按下图装置(固定装置已略去)进行实验
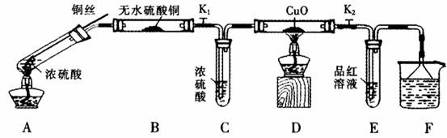
(1)A中反应的化学方程式为: 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_____________。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(4)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
(5)某同学想用SO2气体进行喷泉实验(装置如图所示),烧杯中的溶液可以为 (填序号)
a.NaOH溶液 b.饱和NaHSO3溶液 c.氯水 d. KMnO4溶液
实验Ⅱ:反应产物的定量探究
(6)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)。
查看答案和解析>>
科目:高中化学 来源:2016届江苏常州一中、江阴南菁高中高三两校联考化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.1L2mol·L-1的(NH4)2S溶液中含有的S2-数目为0.2NA
B.7.8g苯中含有C=C键数目为0.3NA
C.常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.4NA
D.用惰性电极电解1L浓度均为2mol·L-1的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4g金属
查看答案和解析>>
科目:高中化学 来源:2016届湖南省株洲市高三上学期期中化学试卷(解析版) 题型:实验题
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(M g3N2)。
g3N2)。
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
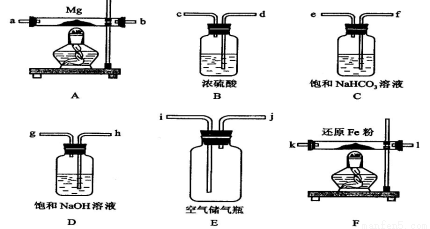
回答下列问题;
(1)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)_______;
(2)通气后,应先点燃________处的酒精灯,再点燃________处的酒精灯,如果同时点燃A、F装置的酒精灯,对实验结果的影响为________;装置F的作用为________。
(3)请设计一个实验,验证产物是氮化镁:_____________________;
(4)已知Mg3N2是离子化合物,证明Mg3N2是离子化合物实验依据是________________。
查看答案和解析>>
科目:高中化学 来源:2016届湖南长沙市三上学期第四次月考化学试卷(解析版) 题型:选择题
将一定质量的铁、氧化铁、氧化铜的混合物粉末放人100mL 4.40mol·L-1盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol·L-1。则原混合物中单质铁的质量是
A.2.24g B.3.36g C.5.60g D.10.08g
查看答案和解析>>
科目:高中化学 来源:2016届辽宁抚顺第一中学高三上第一次模拟考试化学试卷(解析版) 题型:填空题
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
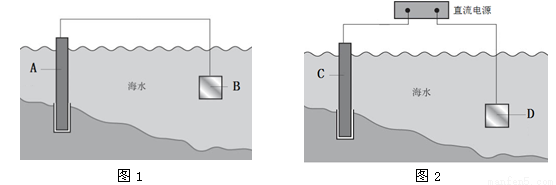
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:__________________________。
(2)图2中,钢闸门C做_____极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为______________________,检测该电极反应产物的方法是_______________________。

(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的极________(填“正”或“负”)。F电极上的电极反应式为___________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com