

 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:期末题 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:
(08枣庄三诊)氨在国民经济中占有重要的地位。现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
|
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
设备A的名称是 ,设备B的名称是 。
(2)硝酸厂的尾气中含有NO和NO2等污染物,籽了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:Na2CO3+2NO2====NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式: 。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用 法和 法进行改进。
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
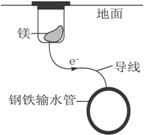
有些化学反应的化学能能直接转化成电能
I.利用 Fe + CuSO4 = FeSO4 + Cu反应,设计一个原电池:
(1)在下框中画出装置图(标明电解质溶液、正、负极和电极材料)

(2)下列说法中,正确的是 。(填字母)
A.电解质溶液中阳离子向负极移动 B.电子通过外导线由负极流向正极
C.当导线中有1mol电子通过时,理论上正极放出1g气体
D.若所选电极的质量相等,理论上两极质量差为60g,导线中有1 mol电子通过
II.三套装置如下图所示, A、B、C烧杯中分别盛有相同物质的量浓度的稀硫酸。

(1)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 ;
(2)若C中电解质溶液是氯化钠溶液,则Fe电极的电极反应式为 ;
III.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
![]()
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。
(1)以下说法中正确的是
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
(2)废弃的镍镉电池已成为重要的环境污染物,资料表明一节废镍镉电池可以使一平方米面积的耕地失去作用价值。在酸性土壤中这种污染特别严重,这是因为
(3)另一种常用的电池是锂电池,锂是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极用金属锂制成,电池总反应可表示为Li+ MnO2 = LiMnO2。
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液(请用化学方程式表示其原因) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com