
���� ��1��һˮ�ϰ���������ܲ��ֵ�������������ӣ�����ͬ����ЧӦ������
��2��ǿ������������Һ��ˮ�������ԣ�笠�����ˮ������һˮ�ϰ��������ӣ����ݵ���غ��жϣ�
��3�����ܵ���ʣ�����Һ�д��ڳ����ܽ�ƽ�⣻笠����ӽ��Mg��OH��2�������������������һˮ�ϰ����ٽ��ܽ�ƽ�����ƣ�
��4����NaF����Һ��ˮ������HF����������������HF��
��̼����ˮ���Լ��ԣ������еĶ������������������ӷ�Ӧ���ɹ����ƣ�
��� �⣺��1��һˮ�ϰ���������ܲ��ֵ�������������ӣ�����뷽��ʽΪ��NH3•H2O?NH4++OH-����ˮ�м���NH4Cl���壬��Һ��笠�����Ũ������һˮ�ϰ��ĵ���ƽ�����淽���ƶ�����ˮ�ĵ���̶ȼ�С����Һ������������Ũ�ȼ�С��pH��С��
�ʴ�Ϊ��NH3•H2O?NH4++OH-����С����С��
��2��NH4Cl����ǿ������������Һ��ˮ�������ԣ�笠�����ˮ������һˮ�ϰ��������ӣ���ˮ�ⷽ��ʽΪ��NH4++H2O?NH3•H2O+H+����Һ�д��ڵ���غ�c��NH4+��+c��H+��=c��Cl-��+c��OH-���������������İ�ˮ��ʹ��Һ��c��NH4+��=c��Cl-������c��H+��=c��OH-����������Һ��pH=7��
�ʴ�Ϊ���NH4++H2O?NH3•H2O+H+��7��
��3��Mg��OH��2���ܽ�ƽ�ⷽ��ʽΪMg��OH��2��s��?Mg2+��aq��+2OH-��aq������Mg��OH��2��Һ�м���Ũ��NH4Cl��Һ��һˮ�ϰ���������þ���ѵ��룬����笠����ӻ�����������������һˮ�ϰ�����ʹ������þ���ܽ⣬���ӷ���ʽΪ Mg��OH��2��s��+2 NH4+�TMg2++2NH3•H2O��
�ʴ�Ϊ��Mg��OH��2��s��?Mg2+��aq��+2OH-��aq���������ܽ⣻
��4����NaF����Һ��ˮ������HF����ˮ�ⷽ��ʽΪ��F-+H2O?HF+OH-�������еĶ�������������HF���䷴ӦΪ��4HF+SiO2�TSiF4��+2H2O��
�ʴ�Ϊ��F-+H2O?HF+OH- 4HF+SiO2�TSiF4��+2H2O��
��̼����ˮ���Լ���CO32-+H2O?HCO3-+OH-�������еĶ������������������ӷ�Ӧ���ɹ��������2OH-+SiO2�TSiO32-+H2O��
�ʴ�Ϊ��CO32-+H2O?HCO3-+OH- 2OH-+SiO2�TSiO32-+H2O��
���� ���⿼����������ʵ��뷽��ʽ��д������ƽ����ƶ�������ˮ�⡢����ת������Ŀ�ѶȲ���ע������ܽ�ƽ�ⷽ��ʽ��д��������ʵ���ƽ�ⷽ��ʽ��д������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
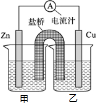 ��1����֪���Ȼ�ѧ����ʽ��
��1����֪���Ȼ�ѧ����ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
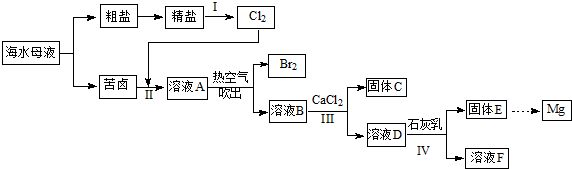
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�� ��� | T���棩 | NO��ʼŨ�� ��mol•L-1�� | CO��ʼŨ�� ��mol•L-1�� | �����ıȱ� �����m2•g-1�� |
| �� | 280 | 1.2��10-3 | 5.8��10-3 | 82 |
| �� | 1.2��10-3 | 124 | ||
| �� | 350 | 82 |
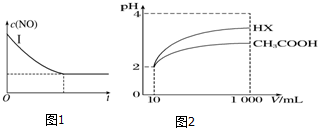
| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ �ⳣ�� | 1.7��10-5 | K1=4.3��10-7 K2=5.6��10-11 | 3.0��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢܢ� | B�� | �ڢۢܢޢ� | C�� | �ڢۢݢޢ� | D�� | �٢ڢݢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A����ĥ��ʯ��ָ���� | B���ս�ճ�����մ� | C��ʪ����ͭ | D������ұ�� |
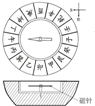 |  |  |  |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com