
分析 (1)钠、Al元素在化合物中只能形成正价价,根据化合价规则确定H的化合价;结合生成氢气的物质的量判断其化学式即可;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,据此书写;
(3)NaAlH4与水反应生成氢气,应是水中的H元素与NaH中的H元素之间得失电子,和盐酸之间反应;
(4)由题意可知NaH常做还原剂那么铁锈为氧化剂,反应生成铁单质,据此书写;
解答 解:(1)Na在化合价中呈现+1价,Al是+3价,所以H是-1价,金属钠和H2反应生成物质的化学式可能为NaH,又甲与AlCl3反应可得到NaAlH4,Al的化合价为+3,故H元素的化合价为-1,4.80g甲加热至完全分解,得到金属钠和2.24L,即0.1mol氢气,
化学反应方程式为:
2NaH$\frac{\underline{\;\;△\;\;}}{\;}$2Na+H2↑
48g 22.4L
4.8g 2.24L
故此化合物为NaH,
故答案为:-1;NaH;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,根据原子守恒推测另一种生成物,化学反应方程式为:4NaH+AlCl3=NaAlH4+3NaCl,
故答案为:4NaH+AlCl3=NaAlH4+3NaCl;
(3)NaAlH4与水反应生成氢气,即NaH中H化合价升高,水中H元素化合价降低,化学反应方程式为:NaAlH4+2H2O=NaAlO2+4H2↑,NaAlH4与盐酸反应的化学方程式为:NaAlH4+4HCl=NaCl+AlCl3+4H2↑;故答案为:NaAlH4+4HCl=NaCl+AlCl3+4H2↑;
(4)NaH常做还原剂(H化合价升高为+1价),铁锈在此为氧化剂(Fe化合价降低为0价),反应生成铁单质,化学反应方程式为:3NaH+Fe2O3=2Fe+3NaOH,
故答案为:3NaH+Fe2O3=2Fe+3NaOH.
点评 本题主要考查的是常见元素以及其化合物的知识,综合性较强,涉及物质的判断、化学反应方程式书写、实验方案的评价等,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.
某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+O2$\stackrel{点燃}{→}$CO2 | B. | C(s)+O2(g)$\stackrel{点燃}{→}$CO2(g)+393.5kJ | ||
| C. | C(s)+O2(g)$\stackrel{点燃}{→}$CO2(g) | D. | C(s)+O2(g)=CO2(g)+393.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 :3-甲基-3-戊醇
:3-甲基-3-戊醇 :4-甲基-2-戊烯
:4-甲基-2-戊烯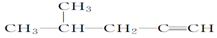 :4-甲基-1-戊炔
:4-甲基-1-戊炔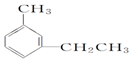 :1-甲基-3-乙苯(或间甲乙苯).
:1-甲基-3-乙苯(或间甲乙苯).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠不可露置在空气中,要密封保存 | |
| B. | 剩余的金属钠应放回原试剂瓶 | |
| C. | 氢氟酸应密封保存在玻璃瓶中 | |
| D. | 实验室保存FeCl2时常向其中加入铁屑 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
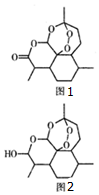 2011年9月12日,中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示.下列有关青蒿素的说法错误的是( )
2011年9月12日,中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示.下列有关青蒿素的说法错误的是( )| A. | 青蒿素耐高温且易溶于水不易溶于乙醚、乙酸乙酯等有机溶剂 | |
| B. | 青蒿素分子内的1个过氧基团是对付疟原虫的核心基团 | |
| C. | 1mol青蒿素分子在碱性条件下彻底水解需消耗1mol分子水 | |
| D. | 药效比青蒿素高10倍的双氢青蒿素(见图2)化学式为C15H24O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白酒 | B. | 纯碱 | C. | 白糖 | D. | 食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 | |
| B. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 0.1molNa2O2与足量二氧化碳充分反应转移的电子数为0.2NA | |
| D. | 0.1molFe在0.1mol氯气中燃烧,转移的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com