
【题目】下列说法错误的是
A. 燃料的燃烧反应都是放热反应
B. 一定量的燃料完全燃烧放出的热量比不完全燃烧放出的热量大
C. 放热反应的逆反应一定是吸热反应
D. 加热能发生的反应是吸热反应
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( )
A.食盐与蔗糖的熔化B.汞和溴的挥发
C.碘和干冰的升华D.二氧化硅和氧化钠的熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲烷是最简单的烷烃,其含碳量最高
B. 烷烃完全燃烧,生成CO2和H2O的物质的量相等
C. 烯烃的分子组成中,碳和氢的质量比固定不变,烯烃通式为CnH2n(n≥2)
D. 分子式:C3H6和C4H8一定互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应” 的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有 熔融物落人沙中”。査阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | — |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理:________(填“合理”或“不合理”)。
(2)设汁一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为___________。
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。若铁被氧化为Fe3+,在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
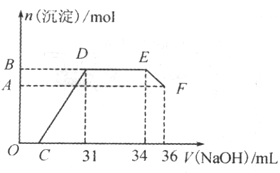
回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为____________。在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____________。
(2)B与A的差值为_________mol。B点对应的沉淀的物质的量为___________mol,C点对应的氢氧化钠溶液的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期律表明
A. 随着原子序数的增大,元素的主要化合价逐渐增加
B. 随着相对原子质量的增大,元素的化学性质会不断重复
C. 与碱金属相比,其相邻主族的(碱土)金属具有更小的密度和硬度
D. 卤素氢化物的稳定性随着核电荷数的增加而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别表示温度、pH与酶活性的关系。下列错误的叙述是
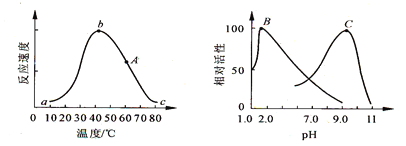
A. 酶活性随温度的升高而增强
B. 曲线A上的b点表示该酶的最适温度
C. 人体胃蛋白酶的活性与曲线B相似
D. 曲线B、C说明不同酶有不同的最适pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用分子式C8H10O所表示的某类化合物具有苯环,并且和FeCl3溶液发生反应且溶液显紫色,这种化合物的同分异构体有( )
A.9种
B.10种
C.11种
D.12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2 mol N2,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
(2)碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
活性炭(mol) | NO(mol) | A(mol) | B(mol) | |
初始 | 2.030 | 0.100 | 0 | 0 |
平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
在T1 ℃时,达到平衡共耗时2分钟,则NO的平均反应速率为________mol·L-1·min-1;当活性炭消耗0.015 mol 时,反应的时间________(填“大于”、“小于”或“等于”)1分钟。
(3)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

①该反应在0~8 min内CO2的平均反应速率是___________mol·L-1·min-1。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是________,曲线Ⅱ改变的条件可能是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com