
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均是由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如图所示的关系。下列说法错误的是
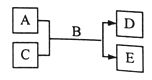
A.简单离子半径大小关系:Y>Z>X>WB.图示反应中有离子键的形成
C.简单阴离子的还原性:Y>ZD.D的水溶液中含有阴、阳离子及共价键形成的分子
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g) △H<0。
CH3OH(g)+ H2O(g) △H<0。
CH3OH的浓度随时间变化如图。回答有关问题:

①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________
②从30分钟到35分钟达到新的平衡,改变的条件可能是__________________________
A.增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)_______________
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3![]() Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为:______________________________________
②电解池中产生CH4一极的电极反应式为:_______________________________________。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
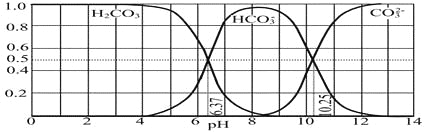
下列叙述正确的是_______________
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器里进行如下可逆反应:![]() 橙黄色液体
橙黄色液体![]() 气
气![]() 鲜红色液体
鲜红色液体![]() 。下列说法正确的是
。下列说法正确的是![]()
![]()
A. 达到平衡时,单位时间里消耗nmol![]() 的同时也生成n
的同时也生成n![]()
B. 增大压强,平衡常数将增大
C. 达到平衡时,若升高温度,氯气的百分含量减小
D. 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍可充电电池以KOH溶液为电解液,放电时的总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法正确的是
A.放电时,正极反应式为Fe-2e-+2OH-=Fe(OH)2
B.放电时,K+向Fe电极迁移
C.充电时,阴极反应式为2Ni(OH)2-2e-+2OH-=Ni2O3+3H2O
D.充电时,阳极附近溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH<0、ΔS>0
B.加热Na2CO3溶液,![]() 增大
增大
C.由热化学方程式2CO(g)+O2(g)=2CO2 (g)ΔH=-566 kJ·mol-1可知,CO的燃烧热是566 kJ·mol-1
D.中和等体积、等浓度的醋酸和盐酸,醋酸消耗的NaOH的物质的量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是
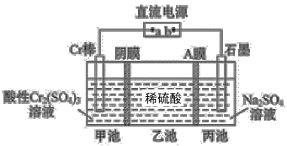
A.b为直流电源的负极
B.阴极反应式为2H++2e-=H2↑
C.工作时,乙池中溶液的pH减小
D.若有1mol离子通过A膜,理论上阳极生成5.6mL气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是燃烧和代谢的最终产物,也是造成温室效应的废气,但
是燃烧和代谢的最终产物,也是造成温室效应的废气,但![]() 作为一种资源,开发和利用的前景十分诱人.
作为一种资源,开发和利用的前景十分诱人.
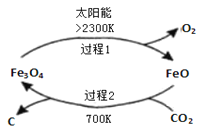
I、利用太阳能,以![]() 为原料制取炭黑的流程如图所示.过程2的化学方程式为______.
为原料制取炭黑的流程如图所示.过程2的化学方程式为______.
II、近年科学家提出“绿色自由”构想.把含有大量![]() 的空气吹入
的空气吹入![]() 溶液中,再把
溶液中,再把![]() 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与![]() 反应生成.其工艺流程如图所示:
反应生成.其工艺流程如图所示:

![]() 由吸收池导入分解池中的主要物质的化学式是______.
由吸收池导入分解池中的主要物质的化学式是______.
![]() 上述流程中______
上述流程中______![]() 填化学式
填化学式![]() 可循环使用,体现了该流程的“绿色”.
可循环使用,体现了该流程的“绿色”.
![]() 不同温度下,在1L恒容密闭容器中充入2mol
不同温度下,在1L恒容密闭容器中充入2mol![]() 和5mol
和5mol![]() ,相同时间内测得
,相同时间内测得![]() 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:

![]() 合成塔中发生的化学反应方程式为______.
合成塔中发生的化学反应方程式为______.
![]() 时a点(正)______ (逆)(填“
时a点(正)______ (逆)(填“![]() ”,“
”,“![]() ”,“
”,“![]() ”);
”);
![]() 计算温度为
计算温度为![]() 时b的平衡常数为______.
时b的平衡常数为______.
![]() 为检验吸收池中饱和
为检验吸收池中饱和![]() 溶液是否充足,量取100mL吸收液用
溶液是否充足,量取100mL吸收液用![]() 盐酸滴定,生成的
盐酸滴定,生成的![]() 标准状况下
标准状况下![]() 随
随![]() 盐酸
盐酸![]() 变化关系如图所示:
变化关系如图所示:

则该100mL吸收液还可吸收标准状况下______![]() .
.
Ⅲ![]() 以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将
以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将![]() 转化为低碳烯烃,工作原理如图所示.
转化为低碳烯烃,工作原理如图所示.

![]() 的移动方向是______
的移动方向是______![]() 填从左至右或从右至左
填从左至右或从右至左![]()
![]() 产生乙烯的电极反应式为______.
产生乙烯的电极反应式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。
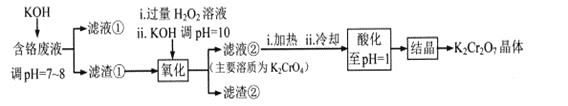
已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:

回答下列问题:
(1)滤渣②的主要成分为___________(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式_______________。
(3)“加热”操作的目的是__________________。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014 L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=_________
Cr2O72-+H2O (K=4×1014 L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=_________
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-1 (NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为 9.00 mL,则产品的纯度为_____________。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然的和绝大部分人工制备的晶体都存在各种缺陷,例如,某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,则该晶体中Ni3+与Ni2+的离子数之比为( )
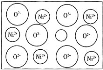
A.6:85B.6:91C.5:91D.5:85
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com