
����Ŀ��A��B��C��D��E��Ϊ������Ԫ�أ�A�����ԭ��������С��Ԫ�أ�B��+1�������Ӻ�C�ĩ�1�������Ӷ�����ԭ�Ӿ�����ͬ�ĵ��Ӳ�ṹ��D��C����һ���ڣ�����B�γ�BD�����ӻ����E��CΪͬһ����Ԫ�أ�������������Ӧ��ˮ����Ϊһ��ǿ�ᡣ�����������Ϣ�ش��������⣺
��1��BԪ����Ԫ�����ڱ��е�λ���ǵ�______����______�壻
��2������CԪ�ص�ԭ�ӽṹʾ��ͼ______��
��3����E���⻯�������������������ȵķ�����______����һ�����ѧʽ����ͬ������������______��
��4��A��D�γɵĻ������к��л�ѧ����������_____��
���𰸡� �� ��A ![]() H2O �� NH3�� HF �� CH4 Na +�� Mg 2+�� NH4 +�� H3O+ ���Թ��ۼ�
H2O �� NH3�� HF �� CH4 Na +�� Mg 2+�� NH4 +�� H3O+ ���Թ��ۼ�
��������A��B��C��D��E��Ϊ������Ԫ�أ�A�����ԭ��������С�ģ���AΪ��Ԫ�أ�B��+1�������Ӻ�C��-1�������Ӷ�����ԭ�Ӿ�����ͬ�ĵ��Ӳ��Ų�����BΪNaԪ�أ�CΪFԪ�أ�D��C����һ���ڣ�����B�γ�BD�����ӻ������DΪClԪ�أ�E��CΪͬһ����Ԫ�أ�������������ˮ����Ϊǿ�ᣬ��EΪNԪ�أ�
��1��BΪNaԪ�أ��������ڱ��е�������IA�壻
��2��CΪFԪ�أ�ԭ�ӽṹʾ��ͼΪ![]() ��
��
��3��E���⻯�����ΪNH3����֮��������������ȵķ�����H2O�ȣ�������OH-��-��
��4��A��D�γɵĻ�����ΪHCl�����й��ۼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ̶����ܱ������ڣ�һ���¶��£����淴ӦA2(g)��3B2(g)![]() 2AB3(g)�ﵽƽ��ı�־��
2AB3(g)�ﵽƽ��ı�־��
A��������ÿ����1mol A2��ͬʱ����2mol AB3
B��������ÿ����1mol A2��ͬʱ����1mol B2
C��������A2��B2��AB3�����ʵ���֮��Ϊ1:3:2
D����������ѹǿ���ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ҵ�л�������������ˮ�������������������������ŷš�
��1����ҵ����NaHSO3��ԭ���������������£������Է�ˮ�м���NaHSO3ʹCr2O72- ��ԭ��ΪCr3+��Ȼ�������ʯ�ҵ��ڷ�ˮ��pH��ʹCr3+��ȫ������
�� д��NaHSO3��Cr2O72-��Ӧ�����ӷ���ʽ��__________________________________��
����֪25��ʱKsp[Cr(OH)3]=6.4��10-31������ȥ��ˮ��Cr3+��ʹ��Ũ��С��1��10-5 molL-1����ʱ��Һ�е�c(H+)<_________molL-1
��2����ˮ�и�Ԫ����Ũ�ȵIJⶨ�������£���һ������Cr2O72-��Cr3+�����Է�ˮ���м�������(NH4)2S2O8��Һ��Cr3+������Cr2O72-����г�ȥ������(NH4)2S2O8���ټ��������KI��Һ��Cr2O72-��I-��ȫ��Ӧ������Cr3+��I2���Ե���Ϊָʾ������Na2S2O3����Һ�ζ����յ㡣�ⶨ���������ʵ�ת����ϵ���£�Cr3+ ![]() Cr2O72-
Cr2O72- ![]() I2
I2 ![]() S4O62-
S4O62-
���������������У�������в�������ⶨ�ĸ�Ԫ����Ũ�Ȼ�________��ѡ�ƫ����ƫС�����䡱����
��ȷ��ȡ��Cr2O72-��Cr3+�����Է�ˮ��100.00 mL�������������ⶨ��ˮ���и�Ԫ����Ũ�ȣ�����0.01000 molL-1��Na2S2O3����Һ13.50 mL������÷�ˮ�и�Ԫ����Ũ�ȣ���mg��L-1��ʾ����д��������̡�_____________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£����淴ӦX(g)+3Y(g)2Z(g)�ﵽƽ��ʱ�����Y��ת����Ϊ37.5%��X��ת����Ϊ25%����Ӧ��ʼʱ�����������е�X��Y�����ʵ���֮����( )
A��1��3 B��3��1 C��1��2 D��3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2017�����ʡТ���и����ϵ�һ��ͳ�����״�����Ҫ�Ĺ�ҵԭ�ϡ�ú������������ú̿��ȡˮú���Ӷ��ϳɼ״���
CO(g)+2H2(g)![]() CH3OH(g)��
CH3OH(g)��
��֪����ѹ�·�Ӧ�������仯��ͼ��ʾ��

��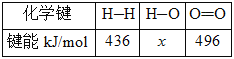
��CO(g)��1/2O2(g)===CO2(g) ��H=��280kJ/mol
H2(g)��1/2O2(g)===H2O(l) ��H=��284kJ/mol
H2O(l)===H2O(g) ��H=+ 44kJ/mol
��ش��������⣺
(1)��д����ʾ��̬�״�ȼ���ȵ��Ȼ�ѧ����ʽ_________________________��
(2)H��O���ļ���xΪ_________kJ/mol��
(3)�״�����ֽ�ΪCO��H2��������ķ�Ӧ�Ļ��Ϊ_________kJ/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2017�����ʡ��ɳ�г�����ѧ������һ��ģ�⡿
��������Ƶ�����֣�����Ӱ�����ǵ�����ͽ�����������Ҫ��Ⱦ��Ϊ�����������PM2.5������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
��1����PM2.5����������ˮ�����Ƴɴ���������
����ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
Ũ��mol/L | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������ж�������pH=_________��
��2������β����NOx��CO�����ɣ�
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g) ��H>0���£������ܱ������У�����˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____
2NO(g) ��H>0���£������ܱ������У�����˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____
A.���������ܶȲ��ٱ仯 B.��������ƽ�����������ٱ仯
C.N2��O2��NO�����ʵ���֮��Ϊ1��1��2 D.�����İٷֺ������ٱ仯
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO(g)=2C(s)+O2(g)����֪�÷�Ӧ����H��0����������ܷ�ʵ��______________����ܡ����ܡ���
��3��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
����úת��Ϊ�������ȼ�ϡ���֪��
H2(g)+ 1/2O2(g) =H2O(g) ��H=��241.8kJ��mol-1
C(s)+1/2O2(g) =CO(g)��H =-110.5kJ��mol-1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ��___________________��
��ϴ�Ӻ�SO2��������
��4������β����������Ҫԭ����2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)����H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����_________������ţ�������ͼ��v����K��n��w�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ���������������
2CO2(g)+N2(g)����H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����_________������ţ�������ͼ��v����K��n��w�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ���������������
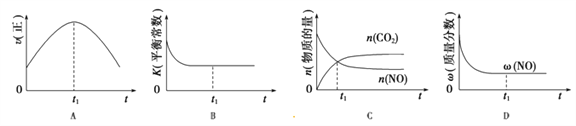
��5�������ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������ġ�������ס�֮һ������̿�ɴ���������Ⱦ��NO����5L�ܱ������м���NO�ͻ���̿�����������ʣ���һ����������������E��F�����¶ȷֱ���T1����T2��ʱ����ø�����ƽ��ʱ���ʵ�����n/mol�����±���
���� �¶�/�� | ����̿ | NO | E | F |
��ʼ | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
�� д��NO�����̿��Ӧ�Ļ�ѧ����ʽ______________________��
������������ӦT1��ʱ��ƽ�ⳣ��K1=__________________����T1��T2����÷�Ӧ����H__________________0(���������������������
�� ������ӦT1��ʱ�ﵽ��ѧƽ�����ͨ��0.1molNO���壬��ﵽ�»�ѧƽ��ʱNO��ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʯ��ʯī����̼�ĵ��ʣ�ʯī��һ�������¿���ת��Ϊ���ʯ����֪12gʯī��ȫת��Ϊ���ʯʱ��Ҫ����EkJ������������˵����ȷ���ǣ���
A. ���ʯ��ʯī��Ϊͬλ�� B. ʯī������ʯ�ȶ�
C. ���ʯ����ʯī�ȶ� D. ��������ʯī����ʯ��ȫȼ�գ�ʯī�ų���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������ȵ�����ͭ��Ӧ�õ������ͽ���ͭ������ͼ�е�װ�ÿ���ʵ�ָ÷�Ӧ��
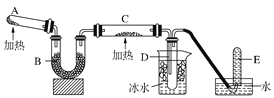
��1���Թ�A�з�����Ӧ�Ļ�ѧ����ʽ��_______________________��
��2��װ��B����ƿ���Լ���ѡ��__������ţ���
a����ʯ�ҡ�b��Ũ���ᡡc�����������ס�d����ˮ�Ȼ���
��3��װ��C��ʢװ��������___________��ʵ��ʱ��C�й۲쵽��������_______��
��4��C�з����Ļ�ѧ��Ӧ����ʽ��________________��
��5�������ʵ���������������____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ������Կ�����ȣ�AG����ʾ��![]() �������£���0.0100molL-l������ε���20.0mL 0.0100molL-l��ˮ�У���Һ��AG�仯��ͼ��ʾ������˵����ȷ����(����)
�������£���0.0100molL-l������ε���20.0mL 0.0100molL-l��ˮ�У���Һ��AG�仯��ͼ��ʾ������˵����ȷ����(����)
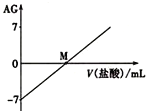
A. M���Ժ�NH4+��ˮ��̶�������
B. �����£�0. 0100molL-l�����AG =12
C. M�����������������20.0 mL
D. M��ʱ��Һ�У�c(NH4+) =c(Cl-)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com