
分析 (1)经2min 建立平衡,此时测得 SO3浓度为 0.8mol•L-1,则
2SO2(g)+O2(g)?2SO3(g)
开始 1 0.5 0
转化 0.8 0.4 0.8
平衡 0.2 0.1 0.8
结合平衡浓度计算K;
(2)K只与温度有关;
(3)结合平衡的特征“等、定”及衍生的物理量判定;
(4)2SO2(g)+O2(g)?2SO3(g)
开始 8 4 0
转化 x 0.5x x
平衡 8-x 4-0.5x x
测得混合气体总物质的量为10mol,则8-x+4-0.5x+x=10,解得x=4,
则平衡时物质的量分别为4mol、2mol、4mol,
使SO2、O2、SO3三种气体均增加1mol,物质的量分别为5mol、3mol、5mol,浓度分别为2.5mol/L、1.5mol/L、2.5mol/L,
Qc=$\frac{2.{5}^{2}}{1.5×2.{5}^{2}}$=0.67,与K比较判断反应方向.
解答 解:(1)(1)经2min 建立平衡,此时测得 SO3浓度为 0.8mol•L-1,则
2SO2(g)+O2(g)?2SO3(g)
开始 1 0.5 0
转化 0.8 0.4 0.8
平衡 0.2 0.1 0.8
K=$\frac{0.{8}^{2}}{0.{2}^{2}×0.1}$=160L•mol-1,
故答案为:160L•mol-1;
(2)K只与温度有关,该反应为放热反应,降低温度,平衡正向移动,K增大,故答案为:B;
(3)A.SO2的转化率和O2的转化率相等,不能判定平衡,故A不选;
B.该反应为体积不等的反应,则容器内压强保持不变,为平衡状态,故B选;
C.v(SO2)逆=2v(O2)正,可知正逆反应速率相等,为平衡状态,故C选;
D.质量、体积均不变,容器内密度始终保持不变,不能判定平衡,故D不选;
故答案为:BC;
(4)2SO2(g)+O2(g)?2SO3(g)
开始 8 4 0
转化 x 0.5x x
平衡 8-x 4-0.5x x
测得混合气体总物质的量为10mol,则8-x+4-0.5x+x=10,解得x=4,
则平衡时物质的量分别为4mol、2mol、4mol,
使SO2、O2、SO3三种气体均增加1mol,物质的量分别为5mol、3mol、5mol,浓度分别为2.5mol/L、1.5mol/L、2.5mol/L,
Qc=$\frac{2.{5}^{2}}{1.5×2.{5}^{2}}$=0.67<K,可知反应向右移动,
故答案为:向右移动.
点评 本题考查化学平衡计算,为高频考点,把握化学平衡三段法、K计算及平衡判定为解答的关键,侧重分析与计算能力的考查,注意(4)中Qc与K的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
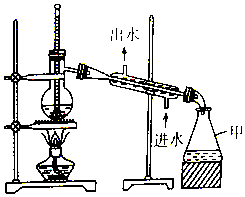
| A. | 仪器甲是锥形瓶,可直接用酒精灯加热 | |
| B. | 温度计水银球应该置于蒸馏烧瓶支管口处 | |
| C. | 直形冷凝管可用球形冷凝管代替 | |
| D. | 石油蒸馏时加沸石,制蒸馏水时不用加沸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
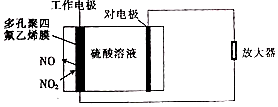 环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )
环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )| A. | “对电极”是负极 | |
| B. | “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O | |
| C. | 传感器工作时H+由工作电极移向对电极 | |
| D. | 对电极的材料可能为活泼金属锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯的水解反应在碱性条件下比在酸性条件下水解更容易 | |
| B. | 油脂的水解可得到甘油,称为皂化反应 | |
| C. | 蛋白质水解的最终产物均为葡萄糖 | |
| D. | 淀粉水解和纤维素水解得到的最终产物相同,它们是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Li>Na>K>Rb>Cs | ||
| C. | 酸性:HClO4>H2SO4>H2SeO4 | D. | 碱性:KOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | FeCl2溶液中混有少量的FeCl3:加入足量的铁粉后过滤 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 硬度由大到小:金刚石>碳化硅>晶体硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com