
| C(标准)×V(标准) |
| V(待测) |
| 10 -14 |
| 10 -8 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
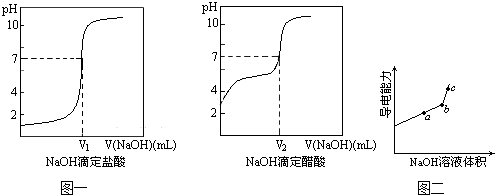
(14分)传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释并 后转移(含洗涤液)到100mL (填仪器名称)中,用 (填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
理由是 。
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。

①滴定管盛放盐酸前,要先 ,然后用蒸馏水冲洗2至3次,再用 ,然后才能盛放盐酸。滴定管中加入盐酸、排净尖嘴部分的气泡后,凹液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③该氨水样品的物质的量浓度为 mol•L-1。
⑷另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使NH+ 4浓度下降,这样,恰好完全反应时NH+ 4浓度不是最大值,溶液导电性就不会是最大值。
①你认为学习小组乙的结论是否正确? (填“正确”、“不正确”)
②当溶液pH=7时,溶液中各离子浓度大小的关系是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年宁夏银川一中高二下学期期中考试化学试卷 题型:实验题
(14分)传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判 断滴定终点。实验步骤如下:
断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释并 后转移(含洗涤液)到100mL (填仪器名称)中,用 (填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。 如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
理由是 。
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的 曲线图。
曲线图。
①滴定管盛放盐酸前,要先 ,然后用蒸馏水冲洗2至3次,再用 ,然后才能盛放盐酸。滴定管中加入盐酸、排净尖嘴部分的气泡后,凹液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③该氨水样品的物质的量浓度为 mol?L-1。
⑷另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使NH+ 4浓度下降,这样,恰好完全反应时NH+ 4浓度不是最大值,溶液导电性就不会是最大值。
①你认为学习小组乙的结论是否正确? (填“正确” 、“不正确”)
、“不正确”)
②当溶液pH=7时,溶液中各离子浓度大小的关系是 。
查看答案和解析>>
科目:高中化学 来源:2012届宁夏高二下学期期中考试化学试卷 题型:实验题
(14分)传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释并 后转移(含洗涤液)到100mL (填仪器名称)中,用 (填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
理由是 。
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。
①滴定管盛放盐酸前,要先 ,然后用蒸馏水冲洗2至3次,再用 ,然后才能盛放盐酸。滴定管中加入盐酸、排净尖嘴部分的气泡后,凹液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③该氨水样品的物质的量浓度为 mol•L-1。
⑷另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使NH+ 4浓度下降,这样,恰好完全反应时NH+ 4浓度不是最大值,溶液导电性就不会是最大值。
①你认为学习小组乙的结论是否正确? (填“正确”、“不正确”)
②当溶液pH=7时,溶液中各离子浓度大小的关系是 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释后转移到100mL (填仪器名称)中(洗涤液也转入),加蒸馏水,最后用 (填仪器名称)定容、混匀后,将所得溶液装入试剂瓶备用。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
 理由是 。
理由是 。
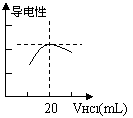
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示
出溶液导电能力与加入盐酸体积关系的曲线图(见右)。
①滴定管盛放盐酸前,要先 ,然后用蒸馏水冲洗
2至3次,再用 ,然后才能盛放盐酸。滴定管
中加入盐酸、排净尖嘴部分的气泡后,凹液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③该氨水样品的物质的量浓度为 mol•L-1。
⑷另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使NH+ 4浓度下降,这样,恰好完全反应时NH+ 4浓度不是最大值,溶液导电性就不会是最大值。
①你认为学习小组乙的结论是否正确? (填“正确”、“不正确”)
②当溶液导电能力达到最大时,溶液中各离子浓度大小的关系是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com