
分析 (1)氨气溶液水生成一水合氨,二氧化碳与一水合氨反应生成碳酸氢铵,氯化钠与碳酸氢铵反应生成氯化铵和碳酸氢钠;
(2)析出小苏打的母液中含有氯化铵,加入生石灰后,生石灰与水反应生成氢氧化钙,氢氧化钙与氯化铵反应生成氨气;
(3)碳酸氢钠不稳定,受热分解生成碳酸钠、水和二氧化碳;
(4)分析比较两种制备流程,结合反应生成产物比较异同,从副产物的主要作用和原料利用等分析比较.
解答 解:(1)氨化的饱和NaCI溶液中通过入CO2,反应生成碳酸氢钠和氯化铵,方程式为:CO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
故答案为:CO2+NH3+H2O=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
(2)析出小苏打的母液中含有氯化铵和碳酸氢钠,加入生石灰后,生石灰与水反应生成氢氧化钙,碳酸氢钠溶液与氢氧化钙反应生成碳酸钙沉淀,氢氧化钙与氯化铵反应生成氨气,发生的化学方程式为:CaO+H2O=Ca(OH)2、NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O、2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:CaO+H2O=Ca(OH)2、NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O、2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)碳酸氢钠受热分解的化学方程式为2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑,故答案为:2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑;
(4)索尔维法缺点:大量CaCl2用途不大,NaCl利用率只有70%,约有30%的NaCl留在母液中;
侯氏制碱法的优点:把合成氨和纯碱两种产品联合生产,提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本.保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96%;NH4Cl可做氮肥;可与合成氨厂联合,使合成氨的原料气CO转化成CO2,减少无用的氯化钙生成;
故答案为:使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用.
点评 本题考查了纯碱的制备原理分析比较,明确物质的性质和生产原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
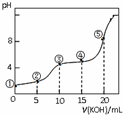 常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )| A. | 点②溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| B. | 点③溶液中:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) | |
| C. | 点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05 mol•L-1 | |
| D. | 点⑤溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+═I2+O2↑+2H2O | |
| C. | 在氢氧化钡溶液中滴加硫酸氢钾溶液至PH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用碳酸钠溶液浸泡锅炉水垢:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
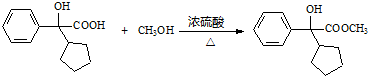 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ② | C. | ①② | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
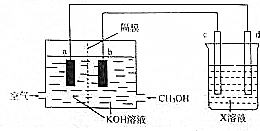
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com