
| A. | NaA溶液中水的电离程度比NaB溶液中水的电离程度大 | |
| B. | 在NaA溶液中:c(Na+)-c(A-)=10-8mol•L-1 | |
| C. | 将两溶液等体积混合,混合溶液的pH约为10 | |
| D. | 在NaB溶液中:c(H+)+c(HB)=10-2mol•L-1 |
分析 25℃时,浓度均为0.1mol•L-1的NaA和NaB溶液的pH分别为8和12,溶液显碱性,说明都是强碱弱酸盐,NaB溶液碱性大于NaA,B-离子水解程度大于A-离子,
A、NaB溶液中B-离子水解程度大于A-离子,对水的电离起到促进作用程度大;
B、溶液中存在电荷守恒计算分析;
C、等体积混合依据溶液中氢氧根离子浓度和物质的量计算混合溶液中的氢氧根离子浓度,结合离子积常数计算氢离子浓度得到溶液pH;
D、溶液中存在质子守恒分析,氢离子存在形式和氢氧根相同.
解答 解:A、NaB溶液中B-离子水解程度大于A-离子,对水的电离起到促进作用,NaA溶液中水的电离程度比NaB溶液中水的电离程度小,故A错误;
B、溶液中存在电荷守恒计算,在NaA溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(A-),溶液pH=8,c(OH-)=10-6mol/L:c(Na+)-c(A-)=10-8mol•L-1-10-6mol/L,故B错误;
C、25℃时,浓度均为0.1mol•L-1的NaA和NaB溶液的pH分别为8和12,溶液中c(OH-)=10-6mol/L,c(OH-)=10-2mol/L,将两溶液等体积混合溶液中请提供离子浓度c(OH-)=$\frac{1{0}^{-6}+1{0}^{-2}}{2}$mol/L≈5×10-3mol/L,c(H+)=$\frac{1{0}^{-14}}{5×1{0}^{-3}}$=2×10-12mol/L,pH≈11.7,故C错误;
D、溶液中存在质子守恒分析,氢离子存在形式和氢氧根相同,在pH=12的NaB溶液中c(OH-)=10-2mol/L,c(OH-)=c(H+)+c(HB)=10-2mol•L-1,故D正确;
故选D.
点评 本题考查了盐类水解应用,电解质溶液中电荷守恒、质子守恒,溶液PH计算分析,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入标准状况下的HCl气体22.4VL | |
| B. | 将溶液加热浓缩到0.5VL | |
| C. | 加入10mol•L-1的盐酸0.2V L,再稀释至1.5VL | |
| D. | 加入VL3 mol•L-1的盐酸混合均匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
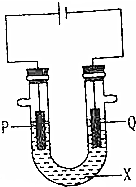 为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.
为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,X属于共价化合物.Y的电子式是
,X属于共价化合物.Y的电子式是 ,Y属于离子化合物.Y中含有的化学键类型有离子键、共价键.
,Y属于离子化合物.Y中含有的化学键类型有离子键、共价键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑦ | B. | ②⑦⑧⑩ | C. | ②④⑥⑦ | D. | ①③⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com