
| A. | 用惰性电极电解1L1mol•L-1的CuSO4溶液,当阴极析出3.2g铜时,加入0.05molCu(OH)2固体可将溶液恢复至原浓度 | |
| B. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H>0 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
分析 A.先确定电解时溶液中析出的物质,再加入相应的物质使溶液恢复到原来状态;
B.根据反应的△S>0以及常温下不能自发进行则△G=△H-T△S>0;
C.难溶盐中阴阳离子个数相等,其中Ksp小的溶解度也一定小;
D.根据离子浓度对化学平衡的影响以及Kw只与温度有关.
解答 解:A.电解CuSO4溶液时,阴极上铜离子得电子生成铜,阳极上失电子析出氧气,所以溶液中析出的物质相当于氧化铜,要使溶液恢复到原来状态,可向溶液中加入0.05 molCuO;而Cu(OH)2相当于氧化铜和水,加入0.05 mol的Cu(OH)2固体,则溶液偏小,故A错误;
B.反应Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)的△S>0,常温下不能自发进行则△G=△H-T△S>0,所以△H>0,故B正确;
C.Ksp(AgCl)>Ksp(Ag2CrO4),但不能说明AgCl的溶解度大于Ag2CrO4的溶解度,故C错误;
D.0.1 mol•L-1 CH3COOH溶液中加入少量CH3COONa固体,CH3COOH电离平衡向逆反应方向移动,电离程度减小,溶液中c(H+)减小,c(OH-)增大,水的电离平衡正向移动,水的电离程度将增大,但Kw不变,故D正确;
故选:BD.
点评 本题主要考查了反应的方向、电解原理、溶解度的比较、电离平衡等,难度中等,注意知识的积累.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:| 容器 | 温度/℃ | 起始物质的量/mol | |
| NO(g) | CO(g) | ||
| 甲 | T1 | 0.20 | 0.20 |
| 乙 | T1 | 0.30 | 0.30 |
| 丙 | T2 | 0.20 | 0.20 |
| A. | 该反应的正反应为吸热反应 | |
| B. | 达到平衡时,乙中CO2的体积分数比甲中的小 | |
| C. | T1℃时,若起始时向甲中充入0.40molNO、0.40molCO、0.40molN2和0.40molCO2,则反应达到新平衡前v(正)<v(逆) | |
| D. | T2℃时,若起始时向丙中充入0.06molN2和0.12molCO2,则达平衡时N2的转化率大于40% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
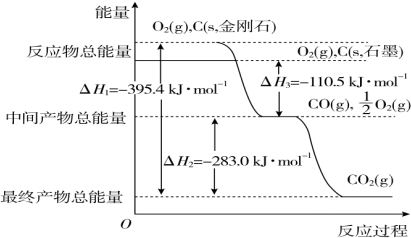
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中滴加Na2CO3溶液,立即产生沉淀和气体 | |
| B. | 若C(Cl-)=0.07mol/L,则溶液的PH为2 | |
| C. | 往溶液中加入NaOH溶液,先生成的沉淀呈红褐色 | |
| D. | 往溶液中通入NH3,直至溶液呈中性,此时溶液中C(NH4+)═C(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与NH3•H2O | B. | NaOH、MgSO4 | C. | Al2(SO4)3、NaOH | D. | BaCl2、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2的溶解度最小 | B. | Ca(OH)2的溶解度最小 | ||
| C. | AgCl的溶解度最小 | D. | 相同条件下Ksp越小的溶解度越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com