
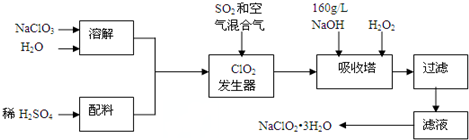
分析 氯酸钠、水和稀硫酸在ClO2发生器中通入二氧化硫和空气反应生成ClO2 ,吸收塔内的反应是氢氧化钠、过氧化氢吸收ClO2 反应生成亚氯酸钠(NaClO2),蒸发浓缩结晶析出,过滤洗涤得到晶体,
(1)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.据此解答.
(2)根据题目信息并运用氧化还原反应理论判断反应物、生成物.根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,化合价降低,被还原;
(3)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2;
(4)从 溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体;
(5)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.溶液颜色蓝色变化为无色分析判断反应终点;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到;
解答 解:(1)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,故选c,
故答案为:c;
(2)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2,
故答案为:2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2;
(3还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产.Na2O2溶于水相当于H2O2.Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难,故选a,
故答案为:a;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,得到的粗晶体经过重结晶可得到纯度更高的晶体,
故答案为:蒸发浓缩、冷却结晶、过滤;
(5)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,离子方程式为:ClO2-+4H++4I-=2I2+Cl-+2H2O,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.溶液颜色蓝色变化为无色分析判断反应终点,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化,
故答案为:滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到,设NaClO2物质的量为x,
ClO2-~2I2~4Na2S2O3+
1 4
x cV×10-3mol
x=$\frac{cV×10{\;}^{-3}}{4}$mol
样品中NaClO2的质量分数=$\frac{\frac{cV×10{\;}^{-3}}{4}×\frac{250}{25}×90.5g/mol}{mg}$×100%=$\frac{22.625cV}{m}$%,
故答案为:$\frac{22.625cV}{m}$%.
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力.题目有一定的难度.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.2g S在反应中转移电子数为0.2NA | |
| B. | 0.1mol Fe在反应中转移电子数为0.3NA | |
| C. | 6.5g Zn在反应中转移电子数为0.2NA | |
| D. | 11.2L O2在反应中转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
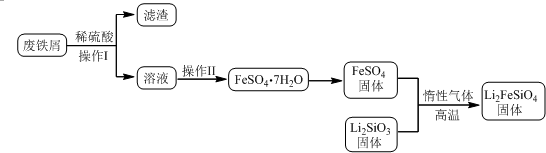
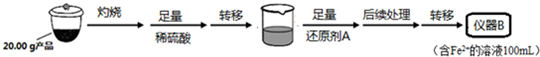
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
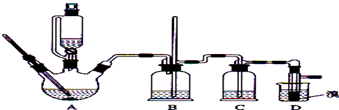
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
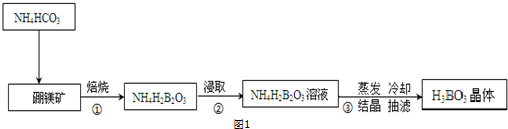
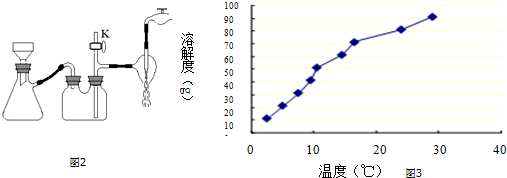
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X的反应速率为0.2 mol/(L•s),则Z的反应速率为0.3 mol/(L•s) | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不变,说明反应已达到平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体平均相对分子质量不变或增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度可能增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小容器体积,NO2体积分数减小,混合气体颜色变浅 | |
| B. | 保持容器体积不变,加入少许NO2,重新达到平衡时,NO2的体积分数增大 | |
| C. | 保持容器体积不变,加入少许N2O4再达到平衡时,气体颜色变深 | |
| D. | 保持容器体积不变,加入少许NO2,将使正反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com