
【题目】(1)NH4Cl溶液显_________性,用离子方程式表示原因____________,其溶液中离子浓度大小顺序为_______________________________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=________ ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_________________。
(3)若将等pH、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m__________n(填“<”、“>”或“=”)。
(4)物质的量浓度相同的NaCl;NaOH;HCl;④NH4Cl;⑤CH3COONa 5种溶液按pH由大到小的顺序为(用④⑤代表相应溶液):_____________。
【答案】酸 NH4++H2O![]() NH3·H2O+H+ c(Cl-)> c(NH4+)> c(H+)> c(OH-) 10-3 mol/L 10-11 mol/L < ②>⑤>①>④>③
NH3·H2O+H+ c(Cl-)> c(NH4+)> c(H+)> c(OH-) 10-3 mol/L 10-11 mol/L < ②>⑤>①>④>③
【解析】
(1)氯化铵溶液中铵根离子水解显酸性,NH4Cl溶液显酸性,水解离子方程式为:NH4++H2O![]() NH3·H2O+H+;溶液中离子浓度由大到小顺序为:c(Cl-)> c(NH4+)> c(H+)> c(OH-);
NH3·H2O+H+;溶液中离子浓度由大到小顺序为:c(Cl-)> c(NH4+)> c(H+)> c(OH-);
(2)在CH3COONa溶液中,OH-全部来自于水的电离,由于溶液的pH=11,故溶液中的氢离子浓度为10-11mol/L,由水电离出来的c(OH-)=![]() =10-3 mol/L;
=10-3 mol/L;
CH3COOH抑制水电离,溶液中的氢氧根离子全部来自于水的电离,pH=3的CH3COOH溶液中, c(H+)=1.0×10-3mol/L,c(OH-)=1.0×10-11mol/L,所以pH=3的CH3COOH溶液中,由水电离出来的c(H+)=10-11mol/L;
(3)NH3H2O是弱电解质,在溶液中部分电离,加水稀释,电离平衡向右移动;NaOH是强电解质,在溶液中完全电离,若将等pH、等体积的NaOH和NH3H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则NaOH稀释的倍数小于NH3H2O,即m<n;
(5)①NaCl ②NaOH ③HCl ④NH4Cl ⑤CH3COONa,显示碱性的为:②NaOH、⑤CH3COONa,氢氧化钠为强碱,CH3COONa为盐,所以pH②>⑤;显示中性的为①NaCl,pH=7;显示酸性的为:③HCl ④NH4Cl,浓度相同时,盐酸为强酸,氢离子浓度最大,而氯化铵为强酸弱碱盐,氢离子浓度较小,所以两种酸性溶液的pH大小关系为:④>③,故物质的量浓度相同时,按pH由大到小的顺序为:②>⑤>①>④>③。


科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。某兴趣小组同学采用镁屑与液溴为原料制备无水MgBr2,设计装置如图所示。已知:Mg与Br2反应剧烈放热;MgBr2具有强吸水性。下列说法正确的是( )

A.冷凝管中冷水进、出口方向错误
B.实验中可以用干燥的空气代替干燥的N2
C.为防止反应过于剧烈,不能用装置C代替装置B
D.装有无水CaCl2固体A的作用是吸收挥发的溴蒸气,防止污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.书写共价化合物的电子式只需把结构式中的一个单键改成一对电子即可
B.已知![]() ,可见,成键的一方不提供电子也可能形成化学键
,可见,成键的一方不提供电子也可能形成化学键
C.将某种化合物溶于水,若能导电说明这种化合物是离子化合物
D.只要是离子化合物其熔点就比共价化合物的熔点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌厂的烟道灰![]() 主要成分为ZnO,另含少量
主要成分为ZnO,另含少量![]() 、CuO、
、CuO、![]() 、MnO等
、MnO等![]() 为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。
为原料可生产草酸锌晶体ZnSO4·2H2O,摩尔质量为189g/mol。
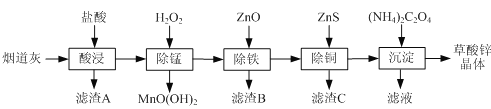
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
请问答下列问题:
(1)滤渣A的主要成分为_________,滤渣B的主要成分为_______________。
(2)除锰过程中产生![]() 沉淀的离子方程式为_______________________。
沉淀的离子方程式为_______________________。
(3) ①除铁![]() 部分
部分![]() 可能被除去
可能被除去![]() 时加入ZnO控制反应液pH的范围为______________。
时加入ZnO控制反应液pH的范围为______________。
②若某溶液中含有![]() ,可能含有
,可能含有![]() ,请设计实验证明
,请设计实验证明![]() 的存在。________。
的存在。________。
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是_______________。
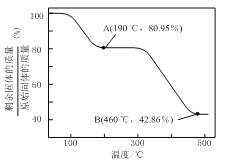
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,![]() 范围内,发生反应的化学方程式为_________________。
范围内,发生反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g![]() 的变化如右图所示。下列说法正确的是
的变化如右图所示。下列说法正确的是

A. 稀释相同倍数时:c(Aˉ)>c(Bˉ-)
B. 水的电离程度:b=c>a
C. 溶液中离子总物质的量:b>c>a
D. 溶液中离子总浓度:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A. 反应剧烈程度:两者相同
B. 消耗硝酸的物质的量:前者多,后者少
C. 反应生成气体的颜色:前者浅,后者深
D. 反应中转移的电子总数:前者多,后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并注明(1)、(2)、(3)的反应类型
(1)由乙烯制备聚乙烯的反应 _______________反应类型:_________________
(2)用甲苯制TNT的反应 __________________反应类型:_________________
(3)溴乙烷与NaOH的乙醇溶液共热 _________________反应类型:_____________
(4)烯烃在一定条件下氧化时,由于C=C键断裂,转化为醛、酮,如:![]() 。若
。若![]() 在上述类似条件下发生反应,请写出反应的方程式 _________________________ 。
在上述类似条件下发生反应,请写出反应的方程式 _________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为反应 2H2(g)+O2(g)=2H2O(g)的能量变化示意图。 下列说法正确的是
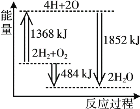
A.拆开 2 mol H2(g)和 1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ 能量
B.由 H、O 原子形成 2 mol H2O(g),共吸收1852 kJ 能量
C.2 mol H2(g)和 1 mol O2(g)反应生成 2 mol H2O(g),共放出484 kJ 能量
D.2 mol H2(g)和 1 mol O2(g)反应生成 2 mol H2O(l),ΔH>-484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作合理或能达到实验目的的是
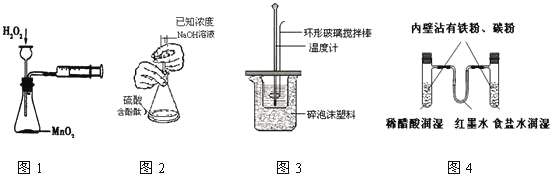
A.图1:实验目的是定量测定化学反应速率
B.图2:用标准NaOH溶液滴定待测H2SO4溶液的物质的量浓度
C.图3:将0.1mol/L 55mLNaOH溶液逐滴加入到0.1mol/L50mL盐酸溶液中测中和热
D.图4:模拟铁的腐蚀实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com