
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是()
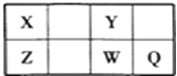
A. 钠与W可能形成Na2W2化合物
B. 由Z与Y组成的物质在熔融时能导电
C. W得电子能力比Q强
D. X有多种同素异形体,而Y不存在同素异形体
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
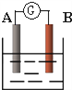
(1)若A为Pb,B为PbO2,电解质溶液为H2SO4溶液,电池的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。则该电池在工作时,A电极的质量将_______(填“增加”、“减小”或“不变”)。若该电池反应消耗了0.1mol H2SO4,则转移电子的数目为_______(设NA为阿伏加德罗常数的值)
(2)若A、B均为铂片,电解质溶液为KOH溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A极的电极反应式:__________________________;该电池工作一段时间后,溶液的碱性将___________(填“增强”、“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向400mL 稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出 NO气体 8.96L(标准状况),同时溶液质量增加 13.2g。下列判断正确的是
A. 反应后的溶液中 c(Fe2+)︰c(Fe3+) =1︰2
B. 原溶液中投入铁粉物质的量是 0.4 mol
C. 原溶液中 HNO3 的浓度是 4.0 mol/L
D. 反应后的溶液中还可溶解 4.8g 铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是重要的矿藏,以黄铜矿为原料生产碱式氯化铜和铁红(氧化铁)颜料的工艺流程如图所示。

(1)反应Ⅰ的离子方程式为_____________,该反应的氧化剂是________________。
(2)反应Ⅱ的离子方程式为_________________________。
(3)反应Ⅵ是在45~50℃的条件下进行的,写出该反应的化学方程式:__________________。
(4)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O,为测定某碱式氯化铜的组成,某实验小组进行下列实验:
①称取样品9.30g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得到AgCl固体1.435g;
③另取25.00mL溶液A,调节pH为4~5,用浓度为0.40mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液50.00mL。通过计算确定该样品的化学式为___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用氧化浓盐酸的方法制取氯气,实验装置如图所示:
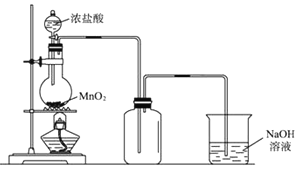
(1)写出制备氯气的离子方程式: ______ ;
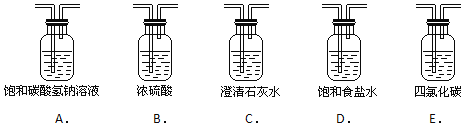
(2)为了得到纯净、干燥的氯气,此装置还需增加净化装置,请根据气体的流动方向,依次按顺序选择所用的装置,正确的选项是 ______ ;
(3)如果将过量二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有:① ______ ;② ______ .
(4)多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______ ;
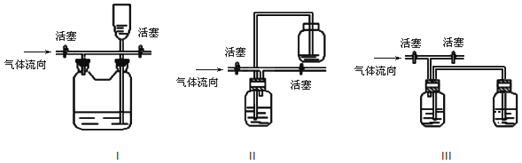
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应。在标准状况下生成11.2LH2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同。
(1)D原子结构示意图为______________,B和C形成的化合物电子式为______________。
(2)B和D简单离子的半径大小为______________。(用离子符号和“>”、“=”或“<”表示)
(3)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是________ (填序号)。
①比较两种单质的颜色 ②比较氢化物的稳定性 ③依据两元素在周期表的位置
④比较原子半径大小 ⑤比较最高价氧化物对应水合物的酸性
(4)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5。则该物质的结构式为__________________________。
(5)关于单质C与冷水反应,下列说法正确的是______________。
①单质C熔化成闪亮的小球,说明该反应是放热反应
②生成H2中含有水蒸汽,液态水变成气态水是吸热反应
③该反应是氧化还原反应,所有氧化还原反应都是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com