
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 Mn2+氧化成MnO4-,Mn元素的化合价由+2价升高为+7价,若反应后R2O8n-离子变为RO42-离子,R的化合价降低,RO42-中R的化合价为+6价,以此来解答.
解答 解:该反应中,锰元素的化合价变化为+2价→+7价,失电子化合价升高,锰离子作还原剂;氧元素的化合价不变,所以R元素得电子化合价降低,R2O8n-作氧化剂,即R2O8n-与Mn2+的物质的量之比为5:2,根据各元素的原子守恒写出并配平该方程式为8H2O+5R2O8n-+2Mn2+=2MnO4-+10RO42-+16H+,根据电荷守恒得-5n+2×2=-1×2+(-2×10)+1×16,n=2,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析能力的考查,注意从化合价角度分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
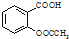 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
| 名称 | 相对分子质量 | 熔点或沸点 (℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙烯水杨酸 | 180 | 135(熔点) | 微溶 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯是制备多种染料和医药的重要中间体,应用极为广泛:用苯、浓硝酸和浓硫酸混合制备硝基苯的装置如图所示:反应物和产物的相关数据列表如下
硝基苯是制备多种染料和医药的重要中间体,应用极为广泛:用苯、浓硝酸和浓硫酸混合制备硝基苯的装置如图所示:反应物和产物的相关数据列表如下| 沸点/℃ | 密度/(g.cm-3) | 水中溶解性 | |
| 苯 | 80.1 | 0.877 | 难溶 |
| 硝基苯 | 210.9 | 1.21 | 难溶 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在自然界中能以游离态存在 | B. | 钠燃烧时发出黄色的火焰 | ||
| C. | 钠能与S、Cl2等非金属反应 | D. | 钠在空气中燃烧生成过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 16.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com