
【题目】在2 L的恒容容器中,充入1 mol A和3 mol B,并在一定条件下发生如下反应:A(s)+3B(g)![]() 2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
①用B表示的反应速率为0.4 mol·L-1·s-1
②3 s时生成C的物质的量为1.2 mol
③3 s时B的浓度为0.6 mol·L-1
A. ①②B. ①③
C. ②③D. ①②③
【答案】C
【解析】
在2 L的恒容容器中,充入1 mol A和3 mol B,并在一定条件下发生如下反应:A(s)+3B(g)![]() 2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,用C表示的化学反应速率为0.6 mol·L-1/3 s=0.2 mol·L-1·s-1,化学反应速率之比等于化学计量数之比,所以用B表示的反应速率为0.3 mol·L-1·s-1,①错误;②3 s时生成C的物质的量为n=cV=0.6 mol/L×2 L=1.2 mol,②正确;③3 s时B转化的物质的量为1.8 mol,剩下的B的物质的量为1.2 mol,所以B的浓度为0.6 mol·L-1,③正确。答案选C。
2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,用C表示的化学反应速率为0.6 mol·L-1/3 s=0.2 mol·L-1·s-1,化学反应速率之比等于化学计量数之比,所以用B表示的反应速率为0.3 mol·L-1·s-1,①错误;②3 s时生成C的物质的量为n=cV=0.6 mol/L×2 L=1.2 mol,②正确;③3 s时B转化的物质的量为1.8 mol,剩下的B的物质的量为1.2 mol,所以B的浓度为0.6 mol·L-1,③正确。答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对于反应3Cl2 + 6NaOH ![]() 5NaCl + NaClO3 + 3H2O,以下叙述正确的是( )
5NaCl + NaClO3 + 3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子与被还原的Cl原子的个数比为1∶5
C.氧化产物与还原产物的物质的量的比为5∶1
D.每生成1mol的NaClO3转移6mol的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】飞秒(1fs=10-15s)化学广泛应用于化学研究。大多双分子反应难于确定反应历程,Zewail通过研究HI与CO2反应巧妙的解决了这个问题,其反应过程中的片断:![]() (1ps=1000fs)。下列说法不正确的是
(1ps=1000fs)。下列说法不正确的是
A.反应过程中CO2未全部断键而HI全部断键
B.HOCO是HI与CO2双分子反应的过渡态产物
C.观察到HOCO解离需用1ps,说明HI与CO2反应极快
D.该反应的起点是HI的解离,终点是OH自由基与I自由基的结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌—空气燃料电池有比能量高、容量大、使用寿命长等优点,可用作电动车动力电源,电池的电解质溶液为 KOH 溶液,放电时发生反应:2Zn + O2+4OH-+2H2O= 2[Zn(OH)4]2-。下列说法正确的是:

A.放电时,负极反应为 Zn-2e- = Zn2+
B.该隔膜为阳离子交换膜,允许K+通过
C.充电时,当 0.1 molO2 生成时,流经电解质溶液的电子个数约为 1.204×1022
D.采用多孔炭可提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温 25 ℃下,向一定量的 0.1 molL-1 的 MOH 溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用 pC 表示,pC=-lgc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是:
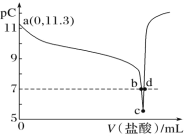
A.MOH 为弱碱,且 Kb 的数量级为![]()
B.随着稀盐酸的加入,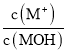 不断减小
不断减小
C.b 点溶液呈中性
D.c 点溶液中水的电离程度最大,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“心得安”是质料心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略):

回答下列问题:
(1)试剂a是____________,试剂b的结构简式为______________,b中官能团的名称是_______________。
(2)③的反应类型是____________________。
(3)心得安的分子式为_______________-。
(4)试剂b可由丙烷经三步反应合成:
![]()
反应1的试剂与条件为_______________,反应2的化学方程式为_______________,反应3的反应类型是_______________。(其他合理答案也可)
(5)芳香化合物D是1-萘(酚)的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E(C2H4O2)和芳香化合物F(C8H6O4), E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。D的结构简式为_______________ ;由F生成一硝化产物的化学方程式为_______________,该产物的名称是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。回答下列相关问题:

Ⅰ. SO2还原CuO探究
(1)装置A中发生反应的化学方程式_______________________________________。
(2)在制取SO2时,使用H2SO4溶液的浓度为__________时(填序号,从下列浓度中选取),制备SO2的速率明显快。请解释不选下列其它浓度硫酸的原因____________________。
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈现蓝色并仍有少量红色不溶物,由此可以得出:
①已知SO2与CuO反应生成两种产物,写出该化学方程式___________________________。
②取红色沉淀物滴加盐酸,反应的离子方程式______________________________________。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制成100mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为____________。
②CuI沉淀物对I3—具有强的吸附能力,由此会造成CuSO4质量分数测定值_______(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图进行电解实验(A、B、C、D均为惰性电极),可供选择的电解质溶液列于下表中。要求满足的条件是:
①工作一段时间后甲中溶液的pH上升,乙中溶液的pH下降;
②B、C两极上放电的离子的物质的量相等。

甲 乙
组别 | ① | ② | ③ | ④ |
甲烧杯 | NaOH溶液 | NaCl溶液 | H2SO4溶液 | AgNO3溶液 |
乙烧杯 | CuSO4溶液 | AgNO3溶液 | AgNO3溶液 | CuCl2溶液 |
(1)应选择的电解质溶液是________组。
(2)电极反应式:B极______________________;D极___________________________。
(3)当B极上析出3.55g电解产物时,C极将析出______(填物质名称)的质量为______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com