
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源:2014-2015学年吉林省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于有机物的叙述正确的是
A.乙醇不能发生取代反应 B.C4H10有三种同分异构体
C.氨基酸、淀粉均属于高分子化合物 D.乙烯和甲烷可用溴的四氯化碳溶液鉴别
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省忻州市高一上入学化学试卷(解析版) 题型:选择题
下列是几种粒子的结构示意图,有关说法不正确的是
①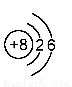 ②
②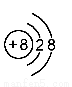 ③
③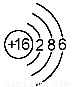 ④
④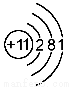
A.①和②属同种元素 B.②属于稀有气体元素
C.①和③的化学性质相似 D.④属于金属元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:填空题
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式,并用双线桥标明电子转移的方向和数目:
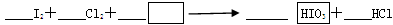 ,该反应的还原剂是________________,当有0.1mol HIO3生成时,反应转移的电子数目为_______。
,该反应的还原剂是________________,当有0.1mol HIO3生成时,反应转移的电子数目为_______。
(2)把KI换成KBr,则CCl4层变成橙红色,继续滴加氯水,CCl4层的颜色没有变化,则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:选择题
下列除杂质的操作中不正确的是
A.除去SO2中的少量HCl:通入饱和NaHSO3溶液的洗气瓶,干燥后收集气体
B.FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤
C.Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液
D.除去SiO2中的少量Al2O3:加入适量稀硫酸充分反应后过滤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上第三次月考化学试卷(解析版) 题型:选择题
当光束通过下列物质时:①豆浆②稀硫酸③蒸馏水④淀粉溶液,没有丁达尔现象的分散系是
A.②③④ B.②④ C.②③ D.②
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
人工光合作用能够借助太阳能,用CO2和H2O来制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
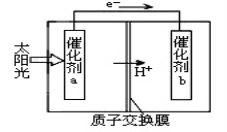
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH
查看答案和解析>>
科目:高中化学 来源:2016届广东省等三校高三上学期12月联考理综化学试卷(解析版) 题型:实验题
非金属元素及其化合物在工农业生产中应用非常广泛。请回答以下问题:
I.氯及其化合物
ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛,某兴趣小组通过如下图所示,对其制备、吸收、释放和应用进行了研究。
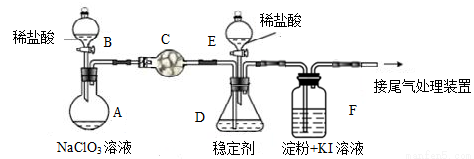
(1)A中发生反应的化学方程式: 。
(2)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
II.硫及其化合物:
(1)选择以下装置,通过实验现象依次完成以下验证:SO2具有酸性、氧化性、还原性、漂白性。其仪器的连接顺序为 。
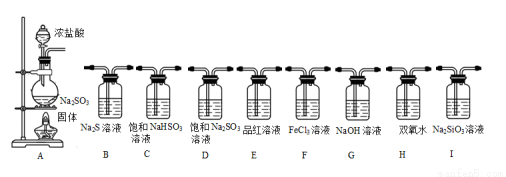
(2)利用下图装置能证明SO2不与BaCl2溶液反应,通入X气体可排除干扰达到实验目的是
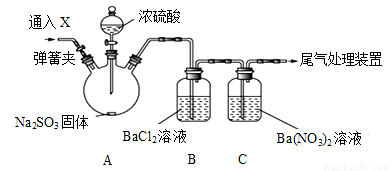
A CO2 B NH3 C O3 D N2 E NO2
C发生的离子方程式 。
(3)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

按上述方案实验,当消耗标准I2溶液25.00 mL时,滴定完毕,滴定终点的标志 ,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
查看答案和解析>>
科目:高中化学 来源:2016届河南省洛阳市高三上学期12月统考化学试卷(解析版) 题型:填空题
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
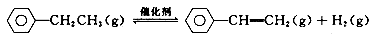
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
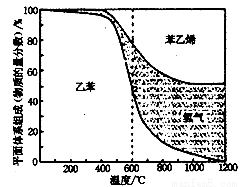
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为 ;
②乙苯的平衡转化率为 ;
③计算此温度下该反应的平衡常数 。
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(3)已知:
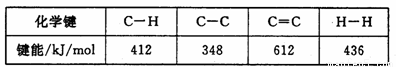
计算上述反应的ΔH= kJ/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com