
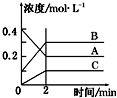
| A. | A是反应物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 达平衡后,若升高温度,平衡向正反应方向移动 | |
| D. | 反应的方程式为:2A(g)?2B(g)+C(g) |
分析 由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A?2B+C,根据v=$\frac{△c}{△t}$计算反应速率.
解答 解:A、由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,故A正确;
B、由图可知前2 minA的△c(A)=0.2mol/L,所以v(C)=$\frac{0.2mol/L}{2min}$=0.1 mol•L-1•min-1,故B正确;
C、根据图象不能确定该反应的反应热,不能判断温度对平衡移动的影响,故C错误;
D、由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A?2B+C,故D正确;
故选C.
点评 本题考查化学平衡图象问题,题目难度不大,注意根据图象书写反应的化学方程式,图是物质的量浓度的变化曲线,不能判断温度对平衡移动的影响.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至多有26个原子处于同一平面上 | |
| C. | 该烃能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁在空气中和纯净氧气中的燃烧产物只有MgO | |
| B. | 硫在空气中的燃烧产物是SO2,在纯净氧气中的燃烧产物是SO3 | |
| C. | 钠在敞口容器中长期放置和在空气中燃烧的产物都是Na2O2 | |
| D. | 浓H2SO4和浓盐酸敞口放置在空气中,其溶质的质量分数都将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X和W组成的化合物属于分子晶体 | |
| B. | Y的气态氢化物比Z的气态氢化物稳定 | |
| C. | X的单质既能与NaOH溶液反应,又能与氢氟酸反应 | |
| D. | 向KI-淀粉溶液中通入某气体后变蓝,则该气体一定是Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ②③④⑤ | C. | ④⑤ | D. | ①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com