
向含有Fe2+、I﹣、Br﹣的溶液中通入适量氯气,溶液中各种离子的物质的量变化曲线如图所示.有关说法不正确的是( )
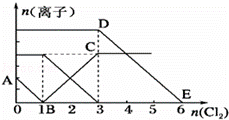
A. 线段BC代表Fe3+的物质的量的变化情况
B. 原混合溶液中c(FeBr2)=6 mol/L
C. 当通入Cl22 mol时,溶液中已发生的离子反应可表示为2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
D. 原溶液中n(Fe2+):n(I﹣):n(Br﹣)=2:1:3
考点: 离子方程式的有关计算.
专题: 计算题.
分析: 还原性I﹣>Fe2+>Br﹣,故首先发生2I﹣+Cl2═I2+2Cl﹣,I﹣反应完毕再发生:2Fe2++Cl2═2Fe3++2Cl﹣;最后发生反应2Br﹣+Cl2═Br2+2Cl﹣,
A.B点时溶液中I﹣完全反应,溶液中存在Fe2+和Br﹣,BC段发生2Fe2++Cl2═2Fe3++2Cl﹣;
B.根据BC段消耗的氯气的物质的量,计算溶液n(Fe2+),但溶液的体积无法计算,不能计算c(FeBr2);
C.根据反应消耗顺序,利用消耗的氯气计算参加反应的离子的物质的量,据此书写;
D.根据各阶段消耗的氯气的物质的量,计算原溶液中n(Fe2+)、n(I﹣)、n(Br﹣),据此解答.
解答: 解:还原性I﹣>Fe2+>Br﹣,故首先发生2I﹣+Cl2═I2+2Cl﹣,I﹣反应完毕再发生:2Fe2++Cl2═2Fe3++2Cl﹣;最后发生反应2Br﹣+Cl2═Br2+2Cl﹣,
A.B点时溶液中I﹣完全反应,溶液中存在Fe2+和Br﹣,BC段发生2Fe2++Cl2═2Fe3++2Cl﹣,代表Fe3+的物质的量的变化情况,故A正确;
B.由图可知,BC段发生2Fe2++Cl2═2Fe3++2Cl﹣,Fe2+反应完毕消耗氯气2mol,由方程式可知n(Fe2+)=2×2mol=4mol,无法得到原溶液的体积,故不能计算原混合溶液中c(FeBr2),故B错误;
C.AB段发生2I﹣+Cl2═I2+2Cl﹣,2mol的I﹣消耗1mol氯气,BC段发生2Fe2++Cl2═2Fe3++2Cl﹣,余下的1mol氯气再与2molFe2+反应,故参加反应的n(Fe2+):n(I﹣)=1:1,故通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣,故C正确;
D.由图可知AB段消耗氯气1mol,发生2I﹣+Cl2═I2+2Cl﹣,故n(I﹣)=2n(Cl2)=2mol,BC段发生2Fe2++Cl2═2Fe3++2Cl﹣,消耗氯气2mol,故n(Fe2+)=2n(Cl2)=2×2mol=4mol,DE段发生2Br﹣+Cl2═Br2+2Cl﹣,消耗氯气3mol,故n(Br﹣)=2n(Cl2)=6mol,故原溶液中n(Fe2+):n(I﹣):n(Br﹣)=4mol:2mol:6mol=2:1:3,故D正确;
故选B.
点评: 本题以图象形式考查氧化还原反应、化学计算,综合性较强,根据离子的还原性强弱结合图象判断各阶段发生的反应是解答该题的关键,是易错题目,难度较大.


科目:高中化学 来源: 题型:
下列说法不正确的是( )
A. 共价化合物和离子化合物中,一定都含有非金属元素
B. 某元素原子最外层只有1个电子,它跟卤素可能形成离子键也可能形成共价键
C. 离子化合物如果能溶于水,其水溶液一定可以导电
D. 共价化合物都是由分子构成的,而离子化合物中一般不存在单个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是( )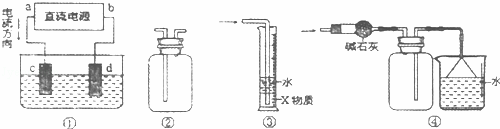
|
| A. | 装置①中,c为阳极,d为阴极 |
|
| B. | 装置②可用于排空气法收集H2、NH3、Cl2、HCl、NO等 |
|
| C. | 装置③中X为四氯化碳,可用于吸收氨气或氯化氢 |
|
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )
编号 ① ② ③ ④
气体M H2S H2 NH3 NO
气体N SO2 Cl2 HCl O2

A. ①②③④ B. ①④③② C. ②④①③ D. ④①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2Na[Al(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O.向含2mol NaOH,1mol Ba(OH)2,2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是( )
选项 A B C D
n(CO2)(mol) 2 3 4 6
n(沉淀)(mol) 1 2 3 3
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、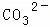 、
、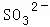 、
、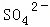 、Cl﹣、
、Cl﹣、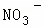 中的一种或几种,取该溶液进行迂续实验,实验内容如下:
中的一种或几种,取该溶液进行迂续实验,实验内容如下:
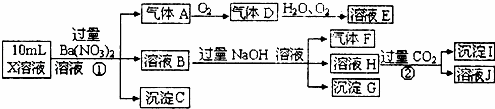
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子是,若要确定其中阳离子的存在,最可靠的化学方法是 + .
(2)沉淀G的化学式为 .
(3)写出有关离子方程式:
步骤①中生成A.
步骤②生成沉淀I.
(4)假设测定A、F、I均为0.01mol,10mLX溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明(1)中不能确定的阴离子存在的理由是. .
查看答案和解析>>
科目:高中化学 来源: 题型:
欲配制100mL 1.0mol/L Na2SO4溶液,正确的方法是( )
①将14.2g Na2SO4溶于100ml水中
②将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100ml
③将20mL 5.0mol/L Na2SO4溶液用水稀释至100ml.
A. ①② B. ②③ C. ①③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl﹣物质的量浓度相同的是( )
|
| A. | 100mL 0.5mol/L MgCl2溶液 |
|
| B. | 200mL 0.25mol/L CaCl2溶液 |
|
| C. | 50ml 1mol/L NaCl溶液 |
|
| D. | 25ml 2mol/L HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com