
��X��Y��Z��W���ֶ���������Ԫ�أ�ԭ������������������X��Zͬ���壬Y��Wͬ���ڣ�Xԭ�ӵ������������Ǻ�����Ӳ�����3����Y�����������W������۵ľ���ֵ��2��������˵����ȷ���� �� ��
| A��Y���ʿ�ͨ�����ȷ�Ӧ�Ƶ� |
| B��X��Z���⻯��е�ߵͣ�X<Z |
| C������Ԫ�صļ����Ӱ뾶��С��Y<X<Z<W |
| D��Y��Z��Ԫ�ص�������������Ӧ���������м������Ӽ����й��ۼ� |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 3 |
| 4 |


| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���Ӵ��� | X | Y | Z | W |
| ԭ�Ӻ��� | ���� | ��ͬԪ�ع��ɵ����� | ͬԪ�ع��ɵ����� | ͬԪ�ع��ɵ����� |
| ���ӵĵ���� | 0 | 0 | ��������� | 0 |


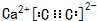
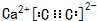

| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
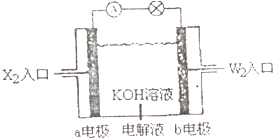 ��X��Y��Z��W���ֶ�����Ԫ�أ�ԭ��������������X�������Ӿ���һ�����ӣ�Z��W�����ڱ��ڴ���ͬһ��������λ�ã����ǵĵ�����ͨ��״���¾�Ϊ��ɫ���壮Yԭ�ӵ������������Ǵ�����������2������ش�
��X��Y��Z��W���ֶ�����Ԫ�أ�ԭ��������������X�������Ӿ���һ�����ӣ�Z��W�����ڱ��ڴ���ͬһ��������λ�ã����ǵĵ�����ͨ��״���¾�Ϊ��ɫ���壮Yԭ�ӵ������������Ǵ�����������2������ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com