
【题目】下列各数值表示元素原子序数,在各组中能以离子键相互结合成稳定化合物的是( )
A. 10和19 B. 6和16 C. 11和17 D. 14和8
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】可用如图装置制取、净化、收集气体的是
选项 | 气体 | ① | ② | ③ |
|
A | NH3 | 浓氨水 | 生石灰 | 浓硫酸 | |
B | SO2 | 浓硫酸 | Na2SO3 | 浓硫酸 | |
C | NO2 | 浓硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | MnO2 | H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
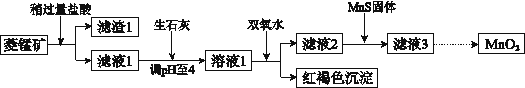
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)盐酸溶解MnCO3的化学方程是______________,滤渣1的主要成分为________________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________________,在CuS和MnS共存的悬浊液中,c(Cu2+)/c(Mn2+)=_____________ (Ksp(CuS)=1.2×10-36,Ksp(MnS)=2.5×10-13)。
(4)在酸性条件下,NaClO3溶液将MnCl2氧化为MnO2,其还原产物为Cl2,该反应的离子方程式为 ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2该反应氧化剂与还原剂物质的量之比为_______________。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:


图1 图2
①电解时发生反应的化学方程式为_______________________________________________ 。
②溶液X中大量存在的阴离子有________________________________________________ 。
③除去ClO2中的NH3可选用的试剂是 ___________________(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用上图2装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为_______________________________。
②玻璃液封装置的作用是________________________________________________。
③V中加入的指示剂通常为___________,滴定至终点的现象是_________________________。
④测得混合气中ClO2的质量为____________________________ g.。
(4)O2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物庾最适宜的是________(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键是
A.一定是共价键 B.一定是离子键
C.可能是共价键,也可能是离子键 D.以上说法均不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲降低废水中重金属元素铬的毒性,可将![]() 转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
阳离子 | Fe3+ | Fe2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 9(>9溶解) | 8 |
(1)某含铬废水处理的主要流程如下图所示:
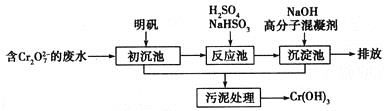
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______________________________。
②请补充并配平以下反应池中发生主要反应的离子方程式:____![]() +____
+____![]() +____===____Cr3++____
+____===____Cr3++____![]() +____H2O。
+____H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-===H2O和_______________________________。证明Cr3+沉淀完全的方法是_____________________________________________________________。
(2)工业可用电解法来处理含![]() 的废水。实验室利用如图模拟处理含
的废水。实验室利用如图模拟处理含![]() 的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
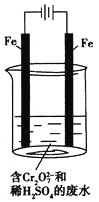
①Fe2+与酸性溶液中的![]() 反应的离子方程式是______________________________。
反应的离子方程式是______________________________。
② 若溶液中含有0.01 mol ![]() ,则阳离子全部生成的沉淀的物质的量是______mol。
,则阳离子全部生成的沉淀的物质的量是______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取10.1g某卤代烃与足量NaOH溶液混合,充分反应后,加入足量AgNO3-HNO3混合溶液,生成18.8g浅黄色沉淀。则该卤代烃可能是
A. CH3Br B. CH3CH2Br C. CH2BrCH2Br D. CH3CHBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
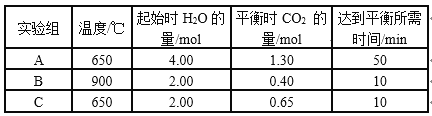
下列说法不正确的是
A. 从实验数据分析,该反应的正反应是吸热反应
B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1
C. 从生产效益分析,C组实验的条件最佳
D. 比较实验B、C,说明C实验使用了更高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com