
【题目】下列实验方法或装置正确的是( )

A. 用图1所示装置制取乙烯
B. 用图2所示方法验证HCl气体易溶于水
C. 用图3所示方法探究固体表面积对反应速率的影响
D. 用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯
【答案】B
【解析】试题分析:A.乙醇与浓硫酸的混合液迅速升温到170℃,才能制取乙烯,因此图1中的温度计水银球位置必须伸入液面下,不能与蒸馏烧瓶支管口相平,A错误;B.挤压胶头滴管使其中水滴入平底烧瓶,如果气体易溶于水,瓶内气压迅速减小,外压大于内压,因此气球膨胀,如果气球不膨胀,则气体不溶于水或溶解度较小,B正确;C.固体颗粒或表面积的大小、溶液的浓度都是影响铁与盐酸反应速率的变量,根据控制变量法原则可知,探究固体表面积对反应速率的影响时,酸溶液的浓度不能改变或必须相同,如果探究酸溶液的浓度对速率的影响,则固体反应物的表面积不能改变或必须相同,C错误;D.溴乙烷与NaOH醇溶液共热时,逸出的气体中可能含有乙烯、乙醇等,乙烯、乙醇都能使酸性高锰酸钾溶液褪色,因此会干扰乙烯的检验,必须在检验之前通过洗气除杂装置,D错误,答案选B。


科目:高中化学 来源: 题型:
【题目】化学让生活更美好。以下说法错误的是( )
A.酒精溶液可以使蛋白质变性,酒精纯度越高杀菌消毒效果越好
B.在烟花中加入某些金属元素,使焰火更加绚丽多彩
C.苏打水呈弱碱性,可以舒缓胃酸分泌过多时的不适感
D.在葡萄酒中添加微量二氧化硫作抗氧化剂,使酒保持良好品质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用C、Fe和Al组成的混合物进行如图所示实物.
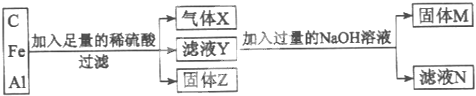
填写下列空白.
(1)气体X为 ,固体Z为 .
(2)滤液Y中除H+外,还含有的阳离子为 和 .
(3)滤液N中除Na2SO4和NaOH外,还含有的溶质为 (填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3: 物质结构与性质】
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为 。
② Fe的基态原子共有 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3 CCl4==="2" KCl+2 CrO2Cl2+3 COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
② COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管 内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )

A.过氧化钠 B.氧化钠
C.钠 D.钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为:Mg17Al12 + 17H2=17MgH2 + 12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
⑴ 熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
⑵ 在6.0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为
Ⅱ.某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2―→O2
⑴ 该反应中的还原剂是
⑵ 该反应中,发生还原反应的过程是 →
⑶ 写出该反应的化学方程式,并标出电子转移的方向和数目 ;
⑷ 若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )

A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,两种酸所用NaOH溶液的体积相等
C.V(NaOH)=10.00 mL 时,![]()
D.V(NaOH)=20.00 mL 时,c(Cl—)<c(CH3COO—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为

A.2:7 B.5:4 C.1:1 D.7:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com