
 神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船.神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验.火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程.
神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船.神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验.火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程. .
.分析 (1)①K2S是离子化合物,硫离子和钾离子形成离子键,据此写出电子式;
②检验溶液中含有K+的实验操作方法是用洁净的铂丝蘸取待测液,放在火焰上灼烧,然后通过蓝色钴玻璃观察火焰颜色,若火焰呈紫色,则溶液中含有钾离子,反之没有;
(2)①利用 NH3+H2O?NH4++OH-分析出肼溶于水呈碱性的离子方程式;
②一种与N2H4电子数相等的绿色氧化剂为H2O2,然后根据PbS转变为白色的PbSO4,H2O2被还原为H2O来分析化学反应;
(3)先根据质量守恒确定氢气的质量,然后求出氮原子、氢原子的物质的量,两者的物质的量之比,确定化合物的分子式,最后书写化学方程式;
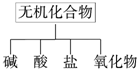
酸是水溶液中电离出的阳离子全部是氢离子的化合物,碱是水溶液中电离出的阴离子全部是氢氧根离子的化合物,盐是金属阳离子和酸根阴离子构成的化合物,氧化物是两种元素组成其中一种使氧元素的化合物;
解答 解:(1)①硫化钾是离子化合物,硫离子和钾离子形成离子键,硫化钾的电子式为: ,故答案为:
,故答案为: ;
;
②用洁净的玻璃棒蘸取少量溶液,在酒精灯上灼烧,透过蓝色的钴玻璃观察火焰颜色,若火焰颜色为紫色,则溶液中含有K+,反之,不含K+;
故答案为:用洁净的玻璃棒蘸取少量溶液,在酒精灯上灼烧,透过蓝色的钴玻璃观察火焰颜色,若火焰颜色为紫色,则溶液中含有K+,反之,不含K+;
②用洁净的铂丝蘸取待测液,放在火焰上灼烧,通过蓝色钴玻璃观察火焰颜色,若火焰呈紫色,则溶液中含有钾离子,反之没有.
(2)①氨气与水的反应为:NH3+H2O?NH4++OH-,肼(N2H4)溶于水显碱性,其原理与氨相似,离子方程式为:N2H4+H2O?NH2NH3++OH-;
故答案为:N2H4+H2O?NH2NH3++OH-;
②一种与N2H4电子数相等的绿色氧化剂是H2O2,能将油画表面黑色的PbS氧化成白色的PbSO4,H2O2被还原为H2O,PbS作还原剂,H2O2作氧化剂,使油画变白、翻新,根据题意及电子守恒、原子守恒,可得反应的化学方程式为:4H2O2+PbO2=PbSO4+4H2O,
故答案为:PbS+4H2O2═PbSO4+4H2O;
(3)86g该化合物爆炸分解会生成标况下N2 67.2L和另一种气体单质H2,N2的物质的量为$\frac{67.2L}{22.4L/mol}$=3mol,质量为3mol×28g/mol=84g,则氢气的质量为86g-84g=2g,物质的量为1mol,氮原子、氢原子的物质的量分别为6mol,2mol,两者的物质的量之比为3:1,含氮化合物的分子式为HN3或H2N6.其爆炸的化学方程式是2HN3=3N2+H2 或 H2N6=3N2+H2.
故答案为:2HN3=3N2+H2 或 H2N6=3N2+H2;
点评 本题以信息为材料,考查了学生运用信息解决问题、分析问题的能力,物质的电子式的书写、物质反应的化学方程式、离子方程式的书写的知识,涉及知识点较多,难度中等,注意知识的迁移与运用.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、NO3-、CO32- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | H+,K+,OH-,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应时,1molNa2O2转移1mol电子 | |
| B. | 78gNa2O2含有阴、阳离子总数是4NA | |
| C. | 1mo1•L-1的AlC13溶液中,C1-离子的数目为3NA | |
| D. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除⑥外 | B. | 除⑤.⑥.⑦.⑧外 | C. | ①.②.⑥.⑦ | D. | ①.③.⑥.⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从晶体类型来看,晶体硅、水晶等物质都是原子晶体,所以具有较高的熔点 | |
| B. | 由于 HClO4(高氯酸)中的非羟基氧比HClO2(亚氯酸)中非羟基氧的多,所以高氯酸的酸性比亚氯酸的酸性强 | |
| C. | 成手性异构的化合物,在三维空间不能重叠,其物理化学性质却完全相同 | |
| D. | SO2分子中,S原子采用sp2杂化轨道成键,该分子的空间构型为平面三角形 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com