
【题目】用如图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是
![]()
A.棉花球处发生的离子反应是Cl2+H2O = H++Cl-+HClO
B.大量白烟是氯化钠固体小颗粒
C.钠着火燃烧产生黄色火焰
D.可在棉花球右侧用湿润的淀粉KI试纸判断氯气是否被碱液完全吸收
【答案】A
【解析】
氯气性质活泼,易与活泼金属钠发生化合反应生成NaCl,火焰呈黄色,氯气易与NaOH溶液反应而被吸收,氯气具有强氧化性,与碘化钾发生置换反应。
A、氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故A错误;
B、氯气性质活泼,易与活泼金属钠发生化合反应生成NaCl,反应时有大量白烟,所以白烟是氯化钠微晶分散在空气中形成,故B正确;
C、钠燃烧时火焰为黄色,故C正确;
D、氯气具有氧化性,则若在棉花球右侧外沿滴一滴淀粉碘化钾溶液,存在剩余氯气时与KI反应生成碘单质,遇淀粉变蓝,所以可据其颜色变化判断氯气是否被碱液完全吸收,故D正确。
答案选A。


科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:
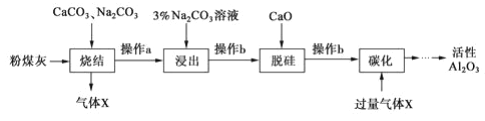
已知烧结过程的产物主要是NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
(1)写出烧结过程中铝元素转化的化学方程式___。
(2)操作 a 为冷却、研磨,其中研磨的目的是___。
(3)①浸出过程中, NaFeO 2 可完全水解,生成沉淀为___。
②3%Na2 CO3溶液显___(填 “酸性 ”、 “碱性 ”或“中性 ”),请用离子方程式解释:___。
(4)操作b 所用的玻璃仪器有漏斗、___、___。
(5)“碳化”时,通入过量气体 x 主要成分的化学式为___。
(6)工业上电解Al2O3制备 Al 是为使Al2O3在较低温下融化,通常加入___。电解过程中做阳极的石墨易消耗,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用 0.1000mol/L KMnO4 酸性溶液滴定未知浓度的无色 H2C2O4 溶液(体积为 20.00mL)。请回答下列问题
(1)该反应的离子方程式是___________________。
(2)盛放高锰酸钾溶液的是___ (填“酸式”或“碱式”)滴定管,其原因是___________________。
(3)滴定终点的现象为______。
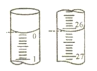
(4)若某次滴定开始和结束时,滴定管中的液面如图所示,则终点的读数为___mL。小明同学根据 3 次实验求得平均消耗高锰酸钾溶液的体积为 VmL,请计算该 H2C2O4溶液的物质的量浓度为___mol/L
(5)下列操作使测定结果偏低的是___(填字母)。
A.酸式滴定管未用标准液润洗直接注入 KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取 KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人们正研究开发一种高能电池——钠硫电池,它以熔融的钠、硫为两极,以Na+导电的β″Al2O3陶瓷作固体电解质,反应为2Na+xS![]() Na2Sx。以下说法正确的是( )
Na2Sx。以下说法正确的是( )
A. 放电时,钠作正极,硫作负极
B. 放电时,Na+向负极移动
C. 充电时,钠极与外电源正极相连,硫极与外电源的负极相连
D. 放电时,负极发生的反应是:2Na-2e-===2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制1.0mol·L-1的NaOH溶液450mL,回答下列问题:
(1)实验步骤:
①计算所需称量的NaOH的质量为___g。
②用托盘天平称量NaOH固体,称量时应将NaOH置于烧杯中放在天平___盘称量。
③将称得的固体放于烧杯中,并加水溶解。
④检查容量瓶不漏水后,立即用玻璃棒引流转移溶液进入___mL容量瓶中。
⑤用少量水洗涤___2-3次;并将洗涤液转移进容量瓶。
⑥用玻璃棒引流向容量瓶中加水,至液面离刻度线1-2cm时,改用胶头滴管滴加至凹液面最低点与刻度线相平。
⑦翻转摇匀后转入试剂瓶中储存。
(2)以上步骤有一步操作不当,写出序号并改正___。
(3)下列操作导致所配溶液的浓度偏大的有___。
A.NaOH中混有Na2O
B.氢氧化钠已潮解
C.容量瓶未干燥即用来配制溶液
D.往容量瓶中移液时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。
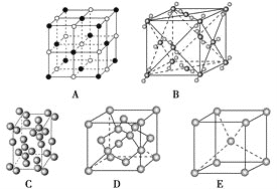
(1)辨别晶胞(请用相应的编号填写)。
①钠晶胞是________;
②碘晶胞是________;
③金刚石晶胞是________;
④干冰晶胞是________;
⑤氯化钠晶胞是________。
(2)与冰的晶体类型相同的是__________。
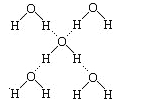
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ·mol-1,除氢键外,水分子间还存在范德华力(11 kJ·mol-1),则冰晶体中氢键的“键能”是________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. ![]() 在核磁共振氢谱中有5个吸收峰
在核磁共振氢谱中有5个吸收峰
B. 红外光谱图只能确定有机物中所含官能团的种类和数目
C. 质谱法不能用于相对分子质量的测定
D. 核磁共振氢谱、红外光谱和质谱都可用于分析有机物结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料合成![]() 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答

(1)写出鉴别苯酚与A这2种有机物的方法,用必要的文字说明: .
(2)写出以下物质的结构简式:B ,F .
(3)写出反应④的化学反应方程式:④ ,
(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制3.6 mol/L的H2SO4溶液80 mL,探究硫酸的性质。实验室有两种不同浓度的硫酸可供选用:① 25%的硫酸(ρ=1.18 g/mL);②98%的硫酸 (ρ=1.8 g/mL)。请回答下列问题:
(1)配制该硫酸溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外还有________;
(2)本实验需量取所选用硫酸的体积为____________________mL;
(3)下列操作会使得所配硫酸溶液浓度偏低的是____________
a.量取硫酸溶液的量筒未用蒸馏水洗涤
b.硫酸稀释后立即转移至容量瓶中
c.转移的时候不小心有少许洒到实验台上
d.定容摇匀时,液面下降又加水
e.定容时仰视刻度线
(4)取所配硫酸溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。试回答:如何证明溶液中的硫酸根离子沉淀完全?__________________________________;
(5)将100mL标号为②的浓硫酸与水(密度为1g/ml)混合,其质量分数为49﹪,则水的体
积________100mL(填“大于”、“小于”、“等于”或“无法确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com