
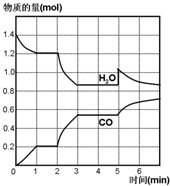
 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:分析 (1)化学平衡常数K=$\frac{生成物浓度系数幂次方}{反应物浓度系数幂次方}$;
(2)据v(CO)=$\frac{\frac{△n(CO)}{V}}{△t}$计算;
(3)图象分析物质水、一氧化碳物质的量不变的时间段为平衡状态;
(4)反应进行至2min时,根据图象知,相同时间内,水和一氧化碳的物质的量变化量大于0-1min内,说明反应速率增大,根据压强和温度对反应速率、化学平衡的影响分析;
(5)反应至第5min时,CO的物质的量不变,水的物质的量增大,说明改变的量是水的物质的量.
解答 解:(1)化学平衡常数K=$\frac{生成物浓度系数幂次方}{反应物浓度系数幂次方}$,$K=\frac{{c(CO).c({H_2})}}{{c({H_2}O)}}$,故答案为:$K=\frac{{c(CO).c({H_2})}}{{c({H_2}O)}}$;
(2)v(CO)=$\frac{\frac{△n(CO)}{V}}{△t}$=$\frac{\frac{0.2mol}{2L}}{1min}$=0.1mol/L.min,故答案为:0.1mol/L.min;
(3)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此判断1~2 min、3~5 min时间段反应达到平衡状态;
故答案为:1~2 min、3~5 min;
(4)反应进行至2min时,根据图象知,相同时间内,水和一氧化碳的物质的量变化量大于0-1min内,说明反应速率增大,水蒸气的物质的量减少,一氧化碳的物质的量增加,说明平衡向正反应方向移动,则该改变的条件只能是升高温度,升温一氧化碳物质的量增大,说明平衡正向进行,正反应为吸热反应,逆反应为放热反应;
故答案为:升高;放;
(5)反应至第5min时,CO的物质的量不变,水的物质的量增大,说明改变的量是增加水的物质的量,随反应进行水蒸气减小,一氧化碳增大,平衡正向进行;
A、增加了C是固体,不影响化学平衡,故A错误;
B、增加了水蒸气,5min时,CO的物质的量不变,水的物质的量增大,故B正确;
C、反应是吸热反应,降低了温度平衡逆向进行,图象不符合,故C错误;
D、增加了压强,平衡逆向进行,不符合图象变化,故D错误;
故答案为:B.
点评 本题考查了化学平衡状态的判断、外界条件对化学平衡的影响,明确化学平衡状态的判断依据、温度和物质的浓度对化学平衡的影响即可解答,注意降低温度时,无论是吸热反应还是放热反应,都降低反应速率,题目难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
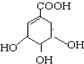 下列关于莽草酸的说法正确的是( )
下列关于莽草酸的说法正确的是( )| A. | 该化合物的分子式为C7H11O5 | |
| B. | 该化合物的分子处于同一平面的原子只有4个 | |
| C. | 该化合物可以与溴水、NaOH、NaHCO3发生反应 | |
| D. | 该化合物在浓硫酸作用下加热不能制备得到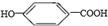 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型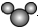 可以表示水分子,也可以表示二氧化碳分子 可以表示水分子,也可以表示二氧化碳分子 | |
| B. | 电子式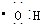 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| C. | 离子结构示意图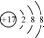 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| D. | 离子方程式HCO3-+H2O?H3O++CO32-可以表示HCO3-离子的水解,也可以表示它的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
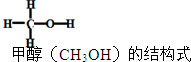 已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表
已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ/mol) | 436 | 414 | 326 | 464 |
| A. | 1070 kJ/mol | B. | 1080 kJ/mol | C. | 1090 kJ/mol | D. | 1100 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学反应中物质变化的实质是旧化学键断裂和新化学键形成 | |
| B. | 燃烧可看成“储存”在物质内部的能量转化为热能、光能等释放出来 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油能使溴的四氯化碳溶液褪色 | |
| B. | 葡萄糖能发生氧化反应和水解反应 | |
| C. | 蔗糖和淀粉都是高分子化合物 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com