
已知:95℃时,KW=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A溶液PH=6,则下列说法正确的是
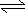
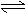 A.H2A在水溶液中的电离方程式为:H2A H++HA-,HA- H++A2-
A.H2A在水溶液中的电离方程式为:H2A H++HA-,HA- H++A2-
B.(NH4)2A溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-)
C.0.0lmol·L-l的H2A溶液pH=2
D.等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,H2A溶液产生的H2多
【知识点】水的离子积常数、溶液pH值、盐溶液中离子浓度 H1 H2 H3
【答案解析】B解析:根据95℃时,KW=1.0×10-12.在该温度下,测得0.1mol·L-1Na2A溶液PH=6,可知溶液呈中性,Na2A为强酸强碱盐。A、H2A为强酸在水溶液中完全电离,故A错误;B、(NH4)2A为强酸弱碱盐,溶液呈酸性,溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-),故B正确;C、0.0lmol·L-l的H2A溶液氢离子浓度为0.02mol·L-l,pH不等于2,故C错误;D、等体积等浓度的盐酸与H2A溶液分别与5.6g Zn反应,若酸都过量,两溶液产生的H2一样多,故D错误。
故答案选B
【思路点拨】本题考查了水的离子积常数、溶液pH值、盐溶液中离子浓度等问题,综合性强,关键是利用95℃时,KW=1.0×10-12和在该温度下0.1mol·L-1Na2A溶液PH=6,判断H2A是强酸。


科目:高中化学 来源: 题型:
配平下列氧化还原反应方程式,并标明反应④电子转移的方向和数目。
① H2S+
H2S+ H2SO3——
H2SO3—— S↓+
S↓+ H2O
H2O
氧化产物是_________,还原产物是__________,二者质量比是________。
② Cl2+
Cl2+ KOH——
KOH—— KCl+
KCl+ KClO3+
KClO3+ H2O
H2O
氧化剂是________,还原剂是________,二者物质的量之比是__________。
③ KClO3+
KClO3+ HCl——
HCl—— KCl+
KCl+ Cl2↑+
Cl2↑+ H2O
H2O
HCl的作用是________,被还原的元素是__________,当反应过程中有3 mol电子转移时,可产生氯气________mol。
④ KIx+
KIx+ Cl2+
Cl2+ H2O——
H2O—— KCl+
KCl+ HIO3+
HIO3+ HCl
HCl
若KIx与Cl2的化学计量数之比为1∶8,则x=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实中,不能用勒·夏特列原理解释的是( )
A.在溴水中存在如下平衡:Br2+H2O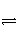
 HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2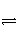
 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C.反应CO+NO2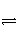
 CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D.合成氨反应:N2+3H2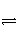
 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
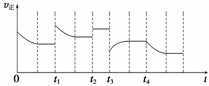
下列说法正确的是( )
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度、不同压强(p1<p2)下,可逆反应X(g)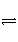
 Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系如下图所示,正确的是( )
Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系如下图所示,正确的是( )
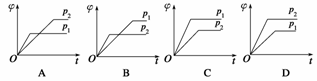
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B、CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C、Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2
D、25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象预测正确的是 ( )

A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
按右图所示的装置进行电解实验,A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极的质量增加7.68 g,溶液的质量增加0.03 g,则铜锌合金中Cu、Zn原子的个数比为
( )。

A.3∶1 B.4∶1 C.2∶1 D.任意比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com