
| A、上述弱酸溶液的pH≈4 |
| B、加入NaOH溶液后,弱酸的电离平衡向右移动,Ka值增大 |
| C、加水稀释后,溶液中所有分子、离子浓度都减小 |
| D、加入等体积0.01 mol?L-1 NaOH溶液后,所得溶液的pH<7 |
| Ka.c |
| 10-6×0.01 |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
 已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,下列说法不正确的是( )
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,下列说法不正确的是( )| A、该反应原理可用于设计氢氧燃料电池 | ||
| B、破坏1 mol H-O 键需要的能量是463.4 kJ | ||
C、H2O(g)=H2(g)+
| ||
| D、H2(g) 中的H-H 键比 H2O(g) 中的H-O 键牢固 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、G、Y、Q、Z、X |
| B、X、Z、Q、G、Y |
| C、X、Z、Q、Y、G |
| D、G、Q、Y、Z、X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的氢化物溶于水显酸性 |
| B、X与Y形成化合物的化学式为X2Y3 |
| C、Y的氧化物是离子化合物 |
| D、X和Z的最高价氧化物对应的水化物都是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 3-n |
| 2 |

| n(OH-) |
| 3n(Fe) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B、氯气和水的反应:Cl2+H2O=2H++Cl-+ClO- |
| C、用氨水溶解氯化银沉淀:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、将过量二氧化硫通入氨水中:SO2+NH3?H2O=HSO3-+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
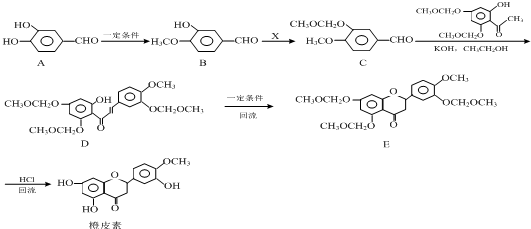
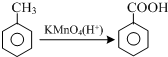 结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备
结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备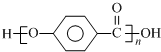 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P的平均反应速率为0.15 mol/(L.min) |
| B、Q的转化率为25% |
| C、Q的平衡浓度为1mol/L |
| D、x的值是2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com